题目内容
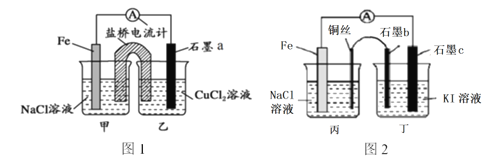
【题目】液相催化还原法去除水体中![]() 是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
Ⅰ.制备Pd-Cu/TiO2的反应过程如下图所示,光照使TiO2发生电荷分离,将金属Pd沉积在TiO2表面。再用类似方法沉积Cu,得到在TiO2纳米颗粒表面紧密接触的Pd-Cu纳米簇。
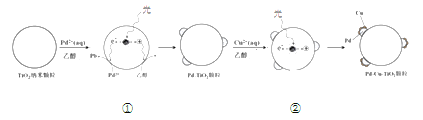
(1)该过程中,乙醇发生__________(填“氧化”或“还原”)反应。
(2)请在②中补全光照条件下形成Pd-Cu纳米簇的反应过程示意图_______。
Ⅱ.Pd-Cu/TiO2分步催化还原机理如图a所示。其他条件相同,不同pH时,反应1小时后![]() 转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
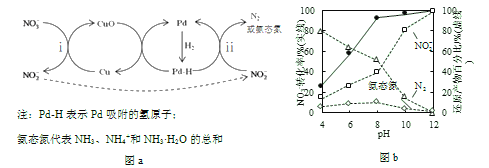
(3)该液相催化还原法中所用的还原剂是__________。
(4)i的离子方程式是__________。
(5)研究表明,OH–在Pd表面与![]() 竞争吸附,会降低Pd吸附
竞争吸附,会降低Pd吸附![]() 的能力,但对Pd吸附H的能力影响不大。
的能力,但对Pd吸附H的能力影响不大。
①随pH增大,N2和氨态氮在还原产物中的百分比均减小,原因是____________,导致反应ⅱ的化学反应速率降低。
②随pH减小,还原产物中![]() 的变化趋势是__________,说明Pd表面吸附的
的变化趋势是__________,说明Pd表面吸附的![]() 和H的个数比变大,对反应__________(用离子方程式表示)更有利。
和H的个数比变大,对反应__________(用离子方程式表示)更有利。
(7)使用Pd-Cu/TiO2,通过调节溶液pH,可将![]() 尽可能多地转化为N2,具体方法是__________。
尽可能多地转化为N2,具体方法是__________。
【答案】氧化  H2 Cu+NO3- = NO2-+CuO 或 H2+NO3-
H2 Cu+NO3- = NO2-+CuO 或 H2+NO3- NO2-+ H2O Pd表面单位面积吸附的
NO2-+ H2O Pd表面单位面积吸附的![]() 数目减小 增大 2NO2-+6H = N2+4H2O+2OH- 先调节溶液的pH到12,待NO3-几乎完全转化为NO2-后,调节pH到4
数目减小 增大 2NO2-+6H = N2+4H2O+2OH- 先调节溶液的pH到12,待NO3-几乎完全转化为NO2-后,调节pH到4
【解析】
根据制备Pd-Cu/TiO2的反应过程示意图,Cu2+、Pb2+得电子发生还原反应,则乙醇发生氧化反应。Pd-Cu/TiO2分两步催化硝酸根离子的转化反应,先将硝酸根离子还原为亚硝酸根离子,再将亚硝酸根离子还原为氮气或氨态氮。
(1)根据制备Pd-Cu/TiO2的反应过程示意图中①,Pb2+得电子发生还原反应,则乙醇发生氧化反应。
(2)根据①的示意图,②中铜离子应得电子生成铜,乙醇与其发生反应,则光照条件下形成Pd-Cu纳米簇的反应过程②示意图为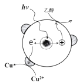 。
。
(3)根据图a可知,氢气生成氨态氮,氢元素的化合价升高,失去电子,作该液相催化还原法中还原剂。
(4)i中铜与硝酸根离子反应生成亚硝酸根离子和铜离子,或Pd-Cu/TiO2作催化剂,硝酸根离子与氢气发生氧化还原反应生成亚硝酸根离子和水,根据得失电子守恒,得到离子方程式Cu+NO3- = NO2-+CuO 或 H2+NO3-![]() NO2-+ H2O。
NO2-+ H2O。
(5)①因为OH–在Pd表面与NO2-竞争吸附,会降低Pd吸附NO2-的能力,随pH增大,OH–浓度增大,导致Pd表面单位面积吸附的 NO2-数目减小,N2和氨态氮在还原产物中的百分比均减小,反应ⅱ的化学反应速率降低。
②根据图b所示,随pH减小,n(N2)增大,n(氨态氮)变化不大,则还原产物中![]() 增大,Pd表面吸附的NO2-和H的个数比变大,NO2-更易转化为N2,根据得失电子守恒,得到对应的离子方程式为2NO2-+6H = N2+4H2O+2OH-。
增大,Pd表面吸附的NO2-和H的个数比变大,NO2-更易转化为N2,根据得失电子守恒,得到对应的离子方程式为2NO2-+6H = N2+4H2O+2OH-。
(7)根据图b所示,pH=12时,NO2-所占的物质的量的百分比最高,pH=4时,N2所占的物质的量的百分比最高,所以先调节溶液的pH到12,待NO3-几乎完全转化为NO2-后,调节pH到4使用Pd-Cu/TiO2,通过调节溶液pH,可将NO3-尽可能多地转化为N2。

【题目】“硫代硫酸银”( [ Ag(S2O3)2]3–)常用于切花保鲜,由AgNO3溶液(0.1 mol·L–1 、pH=6)和Na2S2O3溶液(0.1 mol·L–1、pH=7)现用现配制。某小组探究其配制方法。
(实验一)

(1)A为Ag2S2O3。写出生成A的离子方程式__________。
(2)对实验现象的分析得出,试管a中充分反应后一定生成了__________(填离子符号)。进而推测出沉淀m可能为Ag2S、Ag、S或它们的混合物。做出推测的理由是__________。
(3)若试管a中物质充分反应后不过滤,继续加入1.1 mL Na2S2O3溶液,振荡,静置,黑色沉淀不溶解,清液中逐渐出现乳白色浑浊,有刺激性气味产生。用离子方程式解释产生白色浑浊的原因:__________。
结论:Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液。
(实验二)已知:Ag2S2O3 +3S2O32- ![]() 2 [ Ag(S2O3)2]3–(无色)
2 [ Ag(S2O3)2]3–(无色)
实验操作 | 实验现象 |
i. | 白色沉淀生成,振荡后迅速溶解,得到无色清液; 滴加至约1 mL时清液开始略显棕黄色,有丁达尔现象; 超过1.5 mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色; 滴加完毕,静置,得到黑色沉淀,上层清液pH = 5 |
ii. | 白色沉淀生成,立即变为棕黄色,充分振荡后得到棕黄色清液,有丁达尔现象。 |
(4)用平衡移动原理解释实验i中加入1.5 mL AgNO3后产生白色沉淀的原因:__________。
(5)实验i中,当加入0.5 mL AgNO3溶液时,得到无色清液,若放置一段时间,无明显变化。结合化学反应速率分析该现象与ii不同的原因是__________。
(6)简述用0.1 mol·L–1 AgNO3溶液和0.1 mol·L–1 Na2S2O3溶液配制该保鲜剂时,试剂的投料比和操作:__________。