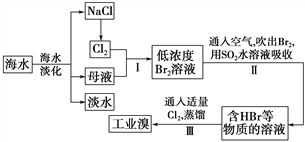
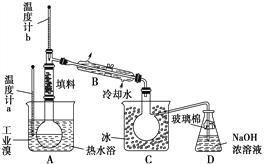
题目内容
【题目】根据下面物质间转换的框图,回答有关问题:
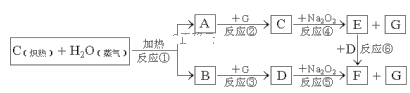
(1)写出框图中物质A和F指代物质的化学式:A___,F___;
(2)在反应①~⑥中属于非氧化还原反应的是___(填写序号);
(3)如果2molNa2O2与足量水蒸气反应生成O2,该反应中转移电子总数是___;
(4)如果A、B混合气体3.0g(平均摩尔质量15g·mol-1),在与G充分反应后,通过足量Na2O2,可使Na2O2增重___g,并得到O2___mol。
【答案】H2 Na2CO3 ⑥ 2NA或1.204×1024 3.0 0.1
【解析】
碳和水蒸气反应生成一氧化碳和氢气,由C+Na2O2→E+G,D+Na2O2→F+G,故G为O2,一氧化碳和氧气反应生成二氧化碳,氢气和氧气反应生成水,二氧化碳和过氧化钠反应生成碳酸钠和氧气,水和过氧化钠反应生成氢氧化钠和氧气,由E与D反应得到F,所以E是NaOH,D是CO2,F是Na2CO3,C是H2O,则A为H2,B为CO,据此解答。
碳和水蒸气反应生成一氧化碳和氢气,由C+Na2O2→E+G,D+Na2O2→F+G,故G为O2,一氧化碳和氧气反应生成二氧化碳,氢气和氧气反应生成水,二氧化碳和过氧化钠反应生成碳酸钠和氧气,水和过氧化钠反应生成氢氧化钠和氧气,由E与D反应得到F,所以E是NaOH,D是CO2,F是Na2CO3,C是H2O,则A为H2,B为CO;
(1)框图中物质A和F指代物质的化学式为,A为H2,F为Na2CO3;
(2)通过以上分析知,反应①是碳和水蒸气反应生成一氧化碳和氢气属于氧化还原反应,②反应是氢气和氧气反应生成水属于氧化还原反应,③反应为一氧化碳和氧气反应生成二氧化碳属于氧化还原反应,④反应是过氧化钠和水的反应属于氧化还原反应,⑤反应为二氧化碳和过氧化钠反应生成碳酸钠和氧气属于氧化还原反应,⑥反应为二氧化碳和氢氧化钠溶液反应生成碳酸钠和水属于复分解反应,不是氧化后反应的只有⑥,故答案为⑥;
(3)由2Na2O2+2H2O=4NaOH+O2 ↑,可知2mol Na2O2与足量水蒸气反应生成氧气为2mol×![]() =1mol,反应中O元素化合价由-1价升高为氧气中0价,转移电子为1mol×2×NAmol-1=2NA;
=1mol,反应中O元素化合价由-1价升高为氧气中0价,转移电子为1mol×2×NAmol-1=2NA;
(4)一氧化碳、氢气与氧气反应生成二氧化碳、水,由2Na2O2+2H2O=4NaOH+O2 ,2Na2O2+2CO2=2Na2CO3+O2 可知,过氧化钠增重等于CO与H2的质量,故过氧化钠增重3.0g;
设混合物中一氧化碳的物质的量是n1,氢气的物质的量是n2,则![]() =15,整理的n1:n2=1:1,由二者质量有28n1+2n2=7.8,联立解得n1=0.1mol,n2=0.1mol;根据元素守恒CO、H2与O2反应后生成0.1molCO2,0.1molH2O,由2Na2O2+2H2O=4NaOH+O2 ,2Na2O2+2CO2=2Na2CO3+O2 可知,生成氧气的体积为
=15,整理的n1:n2=1:1,由二者质量有28n1+2n2=7.8,联立解得n1=0.1mol,n2=0.1mol;根据元素守恒CO、H2与O2反应后生成0.1molCO2,0.1molH2O,由2Na2O2+2H2O=4NaOH+O2 ,2Na2O2+2CO2=2Na2CO3+O2 可知,生成氧气的体积为![]() ×0.1mol+
×0.1mol+![]() ×0.1mol=0.1mol。
×0.1mol=0.1mol。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:
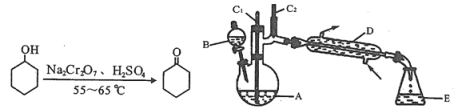
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)