题目内容
【题目】实验室常用碱性溶液吸收多余的氯气,防止环境污染。某次实验中,将多余的氯气用100 mL 2.00 mol·L1的NaOH溶液恰好完全吸收,测得吸收液中ClO与ClO3的物质的量之比为5:1。
(1)吸收的氯气的物质的量为_____________。
(2)吸收液中Cl的物质的量浓度为______________(溶液体积变化忽略不计)。
【答案】0.1mol 1.25mol/L
【解析】
根据吸收液中ClO与ClO3的物质的量之比为5∶1,结合得失电子守恒,写出反应的化学方程式,然后依据方程式分析解答。
(1) ClO-和ClO3-的物质的量浓度之比为5∶1,假设生成的ClO3的物质的量为1,根据得失电子守恒,同时生成氯化钠,且生成的氯化钠为5×1+1×5=10,因此发生的反应为8Cl2+16NaOH=5NaClO+NaClO3+10NaCl+8H2O,NaOH的物质的量为:0.1 L×2.0mol/L=0.2mol,因此吸收的氯气的物质的量为![]() n(NaOH)=0.1mol,故答案为:0.1mol;
n(NaOH)=0.1mol,故答案为:0.1mol;
(2)根据反应的方程式8Cl2+16NaOH=5NaClO+NaClO3+10NaCl+8H2O,生成的氯化钠的物质的量为![]() n(NaOH)=0.2mol×
n(NaOH)=0.2mol×![]() =0.125mol,吸收液中Cl的物质的量浓度为
=0.125mol,吸收液中Cl的物质的量浓度为![]() =1.25mol/L,故答案为:1.25mol/L。
=1.25mol/L,故答案为:1.25mol/L。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:
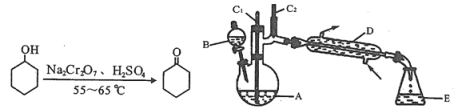
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)
【题目】NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:
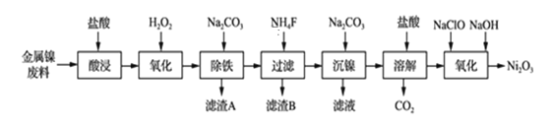
流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_______________等。
(2)加入H2O2的目的是____________,所发生的离子方程式为____________________。
(3)“除铁”时,控制溶液pH的范围为_____________________。
(4)滤渣B的主要成分的化学式为___________________,滤液中的阳离子有________。
(5)“氧化”生成Ni2O3的离子方程式为________________。