题目内容
10.将19.2gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体11.2L(标准状况),(1)则反应中消耗HNO3的物质的量为多少摩尔?
(2)产生的11.2升气体中NO2和NO各为多少摩尔.(要求写出计算过程只写结果不给分)
分析 n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,与硝酸反应生成Cu(NO3)2、NO和NO2,气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,结合N元素守恒、电子守恒计算.
解答 解:n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
(1)由N原子守恒可知,原子守恒得生成硝酸铜需要的n(HNO3)=2n[Cu(NO3)2]=2n(Cu)=2×0.3mol=0.6mol,气体为氮氧化物,气体的物质的量=n(NO)+n(NO2)=0.5mol,根据N元素守恒可知共消耗硝酸的物质的量为0.6mol+0.5mol=1.1mol,
答:消耗HNO3的物质的量为1.1mol;
(2)设NO2和NO各为x、y,
由原子守恒及电子守恒可知,
$\left\{\begin{array}{l}{x+y=0.5}\\{x+3y=0.3×2}\end{array}\right.$,
解得x=0.45mol,y=0.05mol,
答:11.2升气体中NO2和NO各为0.45mol、0.05mol.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子守恒、原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列有关能量的叙述不正确的是( )
| A. | 活化能的大小对化学反应前后的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因 | |
| C. | 盐酸和NaOH(aq)反应的中和热△H=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H=+2 x283.0kJ/mol |
1.在理论上不能用于设计原电池的化学反应是 ( )
| A. | NaCl(aq)+AgNO3(aq)=AgCl(s)+NaNO3(aq )△H<0 | |
| B. | 2KMnO4(s)=2K2MnO4(s)+MnO2(s)+O2(g)△H>0 | |
| C. | 2FeCl3(aq)+Fe(s)=3FeCl3(aq)△H<0 | |
| D. | 2H2(g)+O2(g)=2H2O (l)△H<0 |
15.下列热化学方程式中△H代表燃烧热的是( )
| A. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H1 | B. | S(s)+3/2O2(g)=SO3(s)△H2 | ||
| C. | CH4(g)+2O2(g)=2H2O(l)+CO(g)△H3 | D. | 2CO(g)+O2(g)=CO2(g)△H4 |
2.下列各组元素中,按最高正化合价递减的顺序排列的是( )
| A. | C、N、Cl | B. | F、O、H | C. | S、P、Si | D. | Na、Mg、Al |
19.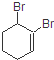 的系统命名的名称是( )
的系统命名的名称是( )
 的系统命名的名称是( )
的系统命名的名称是( )| A. | 1,2-二溴-2-环己烯 | B. | 1,2-二溴-1-环己烯 | ||
| C. | 1,6-二溴-1-环己烯 | D. | 2,3-二溴-1-环己烯 |
20.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
| A. | 氯化铵与苯分别受热变为气体 | B. | 氯化钠与氯化氢分别溶解在水中 | ||
| C. | 碘与干冰分别受热变为气体 | D. | NaHSO4受热熔化与溶于水变为溶液 |
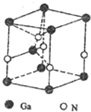 碳、氮元素及其化合物在生产、生活和科学研究等方面有着重要的作用研究它们的结构与性质意义重大.请回答下列有关问题:
碳、氮元素及其化合物在生产、生活和科学研究等方面有着重要的作用研究它们的结构与性质意义重大.请回答下列有关问题: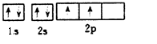 .
.