题目内容
1.在理论上不能用于设计原电池的化学反应是 ( )| A. | NaCl(aq)+AgNO3(aq)=AgCl(s)+NaNO3(aq )△H<0 | |
| B. | 2KMnO4(s)=2K2MnO4(s)+MnO2(s)+O2(g)△H>0 | |
| C. | 2FeCl3(aq)+Fe(s)=3FeCl3(aq)△H<0 | |
| D. | 2H2(g)+O2(g)=2H2O (l)△H<0 |
分析 原电池反应是能自发进行的、放热的、氧化还原反应,据此分析解答.
解答 解:A.该反应不是氧化还原反应,所以不能设计成原电池,故A选;
B.该反应中有电子转移,但是吸热反应,所以不能设计成原电池,故B选;
C.该反应中有电子转移且是放热反应,所以是自发进行的放热的氧化还原反应,所以能设计成原电池,故C不选;
D.该反应中有电子转移且是放热反应,所以是自发进行的放热的氧化还原反应,所以能设计成原电池,故D不选;
故选AB.
点评 本题考查原电池反应性质,明确原电池反应特点是解本题关键,根据反应的自发性、反应热、是否有电子转移判断即可,原电池反应是设计原电池的依据,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
10.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,2.24L苯含有的分子数为0.1nA | |
| B. | 25℃时,PH=13的Ba(OH)2的溶液中含有OH-的数目为0.2nA | |
| C. | 1L0.1mol•L-1Al2(SO4 )3的溶液Al3+的数目为0.2nA | |
| D. | 1.5molNO2与足量H2O反应,转移的电子数为nA |
9.从海带中提取碘元素的步骤中,选用的实验仪器不能都用到的是( )
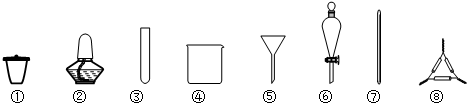

| A. | 海带灼烧灰化,选用①②⑧ | B. | 加水浸泡加热,选用②④⑦ | ||
| C. | 过滤得到滤液,选用④⑤⑦ | D. | 萃取和分液,选用③④⑥ |
16.下列说法正确的是( )
| A. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| B. | 相同浓度和体积的强酸与强碱溶液混合后,溶液的PH=7 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 若反应2A(g)+B(g)=2C(g)在一定条件下是一个自发的反应,则该反应为吸热反应 |
6.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制得Cl2 0.10mol,这时电池内消耗的H2SO4的物质的量至少是( )
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制得Cl2 0.10mol,这时电池内消耗的H2SO4的物质的量至少是( )
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.10 mol | D. | 0.20 mol |
13.能用OH-+H+═H2O 这个离子方程式表示的化学反应的是( )
| A. | 氢氧化铝和硝酸溶液反应 | B. | Fe(OH)3溶液和硫酸反应 | ||
| C. | 氢氧化钡溶液和稀硫酸 | D. | KOH溶液和稀硝酸反应 |
11.食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分,下列关于两种物质的说法正确的是( )
| A. | 炒菜时放入食盐并不破坏NaCl中的化学键 | |
| B. | HCl的电子式是 | |
| C. | NaCl熔化时破坏共价键 | |
| D. | HCl的结构式是H-Cl |
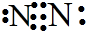 和结构式N≡N.
和结构式N≡N.