题目内容
18. 碳、氮元素及其化合物在生产、生活和科学研究等方面有着重要的作用研究它们的结构与性质意义重大.请回答下列有关问题:
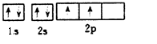
碳、氮元素及其化合物在生产、生活和科学研究等方面有着重要的作用研究它们的结构与性质意义重大.请回答下列有关问题:(1)写出基态氮原子的核外电子排布1s22s22p3,基态碳原子的轨道表示式
 .
.(2)氨是氮的氢化物,它的分子为极性(填“极性”或“非极性”)分子,氨的沸点是同族元素氢化物中较高的,原因是氨分子间易形成氢键.
(3)碳的最高价氧化物中,碳原子的杂化类型为sp.
(4)氮化碳晶体是一种超硬材料,硬度超过金刚石.氮化碳晶体类型为原子晶体,它的熔点比金刚石的熔点高(填“高”或“低”).
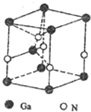
(5)氮化镓(GaN)是制备LED发光二极管的半导体材料,它的晶胞结构如图所示,其中一个晶胞中含有氮原子的个数为2.
分析 (1)N原子核外有7个电子,最外层有5个电子,据此书写核外电子排布;根据构造原理顺序画出C的电子排布式;
(2)氨气为三角锥形分子,属于极性分子,依据氨气中存在氢键解答即可;
(3)CO2分子的结构为O=C=O,根据碳原子成的σ键、孤电子对数目确定杂化轨道数目,进而确定C原子杂化方式;
(4)都属于原子晶体,根据键长分析,键长越长熔点越低;
(5)GaN晶胞中,Ga位于顶点和体心,所以含有Ga数为:8×$\frac{1}{8}$=2,N原子位于棱和体心,所以N数为:4×$\frac{1}{4}$+1=2.
解答 解:(1)氮原子最外层有7个电子,N的电子排布式为1s22s22p3,C最外层有6个电子,C的轨道表示式为: 故答案为:1s22s22p3;
故答案为:1s22s22p3; ;
;
(2)氨气为三角锥形分子,属于极性分子,由于氨气分子间存在氢键,故氨气的熔沸点较高,故答案为:极性;氨气分子间可形成氢键;
(3)CO2分子的结构为O=C=O,C原子成2个σ键键、没有孤电子对,杂化轨道数目为2,故其杂化类型为sp杂化,故答案为:sp;
(4)氮化碳晶体硬度较大,属于原子晶体,立方氮化碳晶体中氮碳键的键长比金刚石晶体中碳碳键的键长要短,故熔点比金刚石的高,故答案为:原子晶体;高;
(5)GaN晶胞中,Ga位于顶点和体心,所以含有Ga数为:8×$\frac{1}{8}$=2,N原子位于棱和体心,所以N数为:4×$\frac{1}{4}$+1=2,故答案为:2.
点评 本题考查原子核外电子排布、晶胞结构与计算、熔沸点比较、杂化轨道等,难度中等,掌握识记中学常见晶胞结构.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
9.从海带中提取碘元素的步骤中,选用的实验仪器不能都用到的是( )
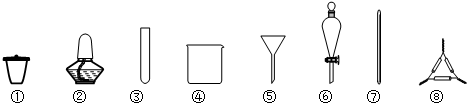

| A. | 海带灼烧灰化,选用①②⑧ | B. | 加水浸泡加热,选用②④⑦ | ||
| C. | 过滤得到滤液,选用④⑤⑦ | D. | 萃取和分液,选用③④⑥ |
6.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制得Cl2 0.10mol,这时电池内消耗的H2SO4的物质的量至少是( )
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制得Cl2 0.10mol,这时电池内消耗的H2SO4的物质的量至少是( )
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.10 mol | D. | 0.20 mol |
13.能用OH-+H+═H2O 这个离子方程式表示的化学反应的是( )
| A. | 氢氧化铝和硝酸溶液反应 | B. | Fe(OH)3溶液和硫酸反应 | ||
| C. | 氢氧化钡溶液和稀硫酸 | D. | KOH溶液和稀硝酸反应 |
3.下列关于烃的性质说法中正确的是( )
| A. | 苯和甲苯都能与浓硝酸发生苯环上的取代反应 | |
| B. | 苯和甲苯都能使酸性高锰酸钾溶液褪色 | |
| C. | 苯和己炔都能使溴的四氯化碳溶液发生化学反应而褪色 | |
| D. | 苯和乙烷与卤素单质发生取代反应都需要铁作催化剂 |
7.下列对化学知识概括合理的是( )
| A. | 金属氧化物都是强电解质 | |
| B. | 一种金属元素只能有一种氧化物 | |
| C. | 在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化 | |
| D. | 能与金属铝反应产生氢气的溶液一定是酸溶液 |
8.下列观点中,你不赞同的是( )
| A. | 淀粉没有甜味,因此不属于糖类 | B. | 肥皂水可以区别硬水和软水 | ||
| C. | 生铁和钢都是铁的合金 | D. | 钢筋混凝土是复合材料 |