题目内容
7.氨氧化法是工业生产中制取硝酸的主要途径,最后烟气中的NOx通常用碳酸钠溶液:NO+NO2+Na2CO3→2NaNO2+CO2;2NO2+Na2CO3→NaNO2+NaNO3+CO2阅读材料,回答下列问题:
(1)氨气和氧气在催化剂存在下的反应方程式为4NH3+5O2→4NO+6H2O.
①5mol NH3和5molO2反应生成4molNO,过量的氨溶于产物水中成为氨水,所得氨水的密度为0.75g/ml,则该氨水的物质的量浓度为6mol/L.
②如果没有催化剂,氨氧化生成NO的同时也生成氮气:4NH3+3O2→2N2+6H2O.若4mol NH3和4molO2恰好完全反应,则产物气体中NO的物质的量为2 mol.
(2)已知真空管中反应2NO2?N2O4,现向一真空管中充入4L标况下的NO2 气体:
①若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为61.3g/mol(保留一位小数).
②将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为2L.
(3)假定产生的烟气中NOx是NO和NO2的混合物(不含N2O4),加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3→3NO2+H2O,当烟气中n(NO):n(NO2)=2:3时,吸收率最高.1m3烟气含2107mgNOx,其中n(NO):n(NO2)=9:1.
计算:①为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数).
②lm3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速.计算结果保留1位小数).
分析 (1)①根据方程式计算参加反应的氨气的物质的量、生成的水的物质的量,进而计算剩余的氨气,再根据m=nM计算水、剩余氨气的质量,根据质量分数定义计算计算出得到的氨水的质量分数,最后根据c=$\frac{1000ρω}{M}$计算出该氨水的物质的量浓度;
②令气体中NO、N2的物质的量分别为xmol、ymol,根据氮原子守恒、电子转移守恒列方程计算
(2)①计算出消耗二氧化氮的体积,然后结合反应方程式计算出生成四氧化二氮的体积,相同条件下气体的物质的量之比等于体积之比,然后根据M=$\frac{m}{n}$计算出平均摩尔质量;
②利用差量法计算出消耗的二氧化氮的体积,再计算出反应后混合气体中含有二氧化氮的体积;
(3)①根据n(NO):n(NO2)=9:1,结合1m3烟气中含有的二者质量计算烟气中n(NO)、n(NO2),令需要加入的硝酸为2x,根据方程式NO+2HNO3→3NO2+H2O可知,反应的n(NO)=x、生成n(NO2)=3x,利用吸收率最高时比例关系列方程计算;
②发生反应NO+NO2+Na2CO3→2NaNO2+CO2、2NO2+Na2CO3→NaNO2+NaNO3+CO2,由方程式可知n(NaNO2)=2n(NO)+$\frac{1}{2}$[n(NO2)-n(NO)],再根据m=nM计算,注意吸收率为90%,实际质量为完全吸收的90%.
解答 解:(1)①参加反应的氨气为nmol、生成的水为bmol,则:
4NH3+5O2=4NO+6H2O
4 4 6
nmol 4mol bmol
所以4:4=nmol:4mol,解得:n=4,
4:6=4mol:bmol,解得:b=6mol,
故剩余氨气为:5molmol-4mol=1mol,
所得氨水的质量分数为:$\frac{1mol×17g/mol}{1mol×17g/mol+6mol×18g/mol}$×100%=13.6%,
所得氨水的密度为0.75g/mL,则该氨水的浓度为:c=$\frac{1000×0.75×13.6%}{17}$:=6mol/L,
故答案为:6;
②设气体中NO、N2的物质的量分别为xmol、ymol,
根据氮原子守恒有:x+2y=4
根据电子转移守恒有:5x+6y=4×2×2
联立解得:x=2,y=1,
故答案为:2;
(2)①在上述反应中有50% NO2的转化为N2O4,根据反应2NO2?N2O4可知,参加反应的二氧化氮的体积为4L×50%=2L,则反应生成的四氧化二氮的体积为:2L×$\frac{1}{2}$=1L,相同条件下气体的体积之比等于其物质的量之比,则反应后二氧化氮与四氧化二氮的物质的量之比为2:1,
所以反应后混合气体的平均摩尔质量为:$\frac{46×2+92×1}{2+1}$g/mol≈61.3g/mol,
故答案为:61.3;
②将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,反应过程中混合气体总体积减少了1L,设参加反应的二氧化氮的体积为x,
2NO2?N2O4 △V
2 1
x 1L,
x=$\frac{1L×2}{1}$=2L,
所以反应后混合气体中含有的NO2的体积为:4L-2L=2L,
故答案为:2L;
(3)①由于n(NO):n(NO2)=9:1,则30×n(NO)+$\frac{1}{9}$n(NO)×46=2.107,解得n(NO)≈0.06mol,设需要加入的硝酸为2x,根据方程式NO+2HNO3→3NO2+H2O可知,反应的n(NO)=x、生成n(NO2)=3x,则(0.06-x):($\frac{1}{9}$×0.06+3x)=2:3,解得x=0.0185mol,故n(HNO3)=2x=0.037mol,
答:为了达到最高吸收率,1m3烟气需用硝酸的物质的量0.037mol;
②发生反应NO+NO2+Na2CO3→2NaNO2+CO2、2NO2+Na2CO3→NaNO2+NaNO3+CO2,由方程式可知n(NaNO2)=2n(NO)+$\frac{1}{2}$[n(NO2)-n(NO)]=$\frac{3}{2}$n(NO)+$\frac{1}{2}$n(NO2)=$\frac{3}{2}$×(0.06mol-0.0185mol)+$\frac{1}{2}$×($\frac{1}{9}$×0.06mol+3×0.0185mol)=0.0887mol,所以m(NaNO2)=0.0933mol×69g/mol×90%=5.8g,
答:吸收后生成NaNO2的质量为5.8g.
点评 本题考查了混合物反应的计算,题目难度较大,明确发生反应的实质为较大关键,试题知识点较大、计算量较大,充分考查了学生的分析能力及化学计算能力.

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案| A. | 能量的释放或吸收是以发生变化的物质为基础的,二者密不可分,但以物质为主,如果物质没有变化,就不能引发能量的变化 | |
| B. | 氢能的优点是燃烧热值高,资源丰富,无毒无污染,且便于储存和运输,因此很可能成为未来的主要能源 | |
| C. | 对于在给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 离子反应的速率决定于溶液中离子的浓度和离子的扩散速率,受温度影响不大,是一类不需要活化能来引发的反应,所以反应速率很高 |
| A. | CO2+H2O=H2CO3分解反应 | |
| B. | Cu(OH)2$\frac{\underline{\;△\;}}{\;}$CuO+H2O 化合反应 | |
| C. | Fe2O3+3CO$\frac{\underline{\;△\;}}{\;}$2Fe+3CO2 置换反应 | |
| D. | NaCl+AgNO3=AgCl↓+NaNO3复分解反应 |
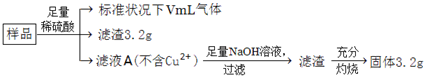
| A. | 滤液A中阳离子不可能含H+、Fe2+、Fe3+ | |
| B. | 样品中金属Fe的质量为2.24g | |
| C. | 样品中CuO的质量为4.0g | |
| D. | V=224 |
| A | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
| B | NaCl(饱和)$→_{②CO_{2}}^{①NH_{3}}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
| C | Fe$→_{点燃}^{少量Cl_{2}}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3 |
| D | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
①Al ②Al2O3 ③Al(OH)3 ④Na2CO3.
| A. | ①③ | B. | ②③④ | C. | ②③ | D. | 全部 |
