题目内容
2.部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.92g,如附图所示流程处理,下列说法中,正确的是( )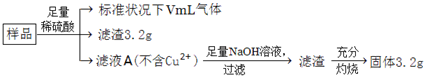
| A. | 滤液A中阳离子不可能含H+、Fe2+、Fe3+ | |
| B. | 样品中金属Fe的质量为2.24g | |
| C. | 样品中CuO的质量为4.0g | |
| D. | V=224 |
分析 硫酸足量,由于氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol,滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,物质的量为0.02mol,铁元素的物质的量为0.04mol,利用极限法判断样品中Fe的质量、CuO的质量问题.
滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.02mol,说明参加反应硫酸物质的量为0.02mol,硫酸含氢离子0.04mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,计算合金中氧原子的物质的量,进而计算氧原子它结合氢离子物质的量,再根据H原子守恒生成氢气的体积.
解答 解:硫酸足量,由于氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol,滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,物质的量为0.02mol,铁元素的物质的量为0.04mol.
A.由上述分析可知,则滤液A中不含铁离子,滤液A中阳离子为Fe2+、H+,故A正确;
B.滤液A中含有亚铁离子和氢离子,加入足量氢氧化钠溶液后,过滤,最后灼烧得到的固体为氧化铁,3.2g氧化铁的物质的量=$\frac{3.2g}{160g/mol}$=0.02mol,含有铁元素的物质的量为0.02mol×2=0.04mol,样品中所有铁元素都生成了氧化铁,所以样品中Fe元素的质量为56g/mol×0.04mol=2.24g,由于部分Fe被氧化成氧化铁,则样品中Fe的质量一定小于2.24g,故B错误;
C.由于硫酸过量,生成氢气,滤液中不含铜离子,滤渣3.2g为金属铜,铜元素的物质的量为0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,故C错误;
D.滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.02mol,说明参加反应硫酸物质的量为0.02mol,硫酸含氢离子0.04mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.04mol×56g/mol=2.24g,Cu元素质量为3.2g,故合金中氧原子的物质的量$\frac{5.76g-2.24g-3.2g}{16g/mol}$=0.02mol,它结合氢离子0.04mol,所以硫酸中生成氢气的H+为0.04mol-0.02mol=0.02mol 即生成0.01mol氢气,标况体积=0.01mol×22.4L/mol=0.224L=224mL,故D正确;
故选:AD.
点评 本题考查混合物计算,根据离子的氧化性强弱明确楚反应过程是解答关键,侧重解题方法与分析解决问题能力的考查,注意利用极限法与原子守恒解答,难度中等.

 名校课堂系列答案
名校课堂系列答案在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0-2 s内该反应的平均速率v=0.0015mol/(L•s).
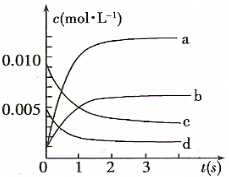
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度d.选择高效催化剂.
| A. | K | B. | Ca | C. | Mg | D. | S |
| A. | 经过特殊改造的塑料也能导电 | B. | 金刚石是自然界最硬的物质 | ||
| C. | SO2不可用作食品防腐剂 | D. | NO可用于某些疾病的治疗 |
| A. | 铝的性质较活泼,难提炼,商代不可能有铝制品 | |
| B. | 铝的质地较软,易变形,不宜做碗 | |
| C. | 铝元素易导致老年痴呆,不宜盛放食物 | |
| D. | 铝的导热性较强,不宜做碗 |
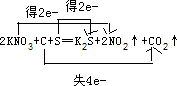 .
.
 保证食品安全、保持营养均衡,是保障人体健康的基础.
保证食品安全、保持营养均衡,是保障人体健康的基础.