题目内容
13.工业制备氯化铜时,将浓盐酸用蒸气加热到80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3].请回答以下问题:(1)第一步除Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?不能,理由是因Fe2+沉淀的pH最大,Fe2+沉淀完全时,Cu2+、Fe3+也会沉淀完全有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是A(填序号);
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?不妥当,理由是引入了新杂质Na+
③现有下列几种常用的氧化剂,可用于除去该混合溶液中Fe2+的有CD(填序号).
A.浓HNO3 B.KMnO4 C.Cl2 D.O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有C(填序号).
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3.
分析 (1)除去Fe2+时,应避免Cu2+生成沉淀;
①NaClO为强碱弱酸盐,水解呈碱性;
②加入氧化剂时,不能引入新的杂质;
③加入氧化剂时,必须既能除去新杂质又不能引入新的杂质;
(2)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质.
解答 解:(1)由题给信息可知,除去Fe2+时,应避免Cu2+生成沉淀,如直接调整溶液pH=9.6,则生成氢氧化亚铁的同时,氢氧化铜、氢氧化铁也同时生成,
故答案为:不能;因Fe2+沉淀的pH最大,Fe2+沉淀完全时,Cu2+、Fe3+也会沉淀完全;
①NaClO为强碱弱酸盐,水解呈碱性,则加入NaClO,溶液的pH一定增大,另外NaClO可以酸反应生成HClO而导致溶液pH增大,故答案为:A;
②加入氧化剂时,不能引入新的杂质,如用NaClO,则可引入NaCl杂质,故答案为:否;引入了新杂质Na+;
③加入氧化剂时,必须既能除去新杂质又不能引入新的杂质.
A.浓HNO3能引入NO3-,故A错误;
B、KMnO4被还原为Mn2+,故引入了新杂质,故B错误;
C、Cl2能氧化Fe2+且引入的Cl-不是杂质,故C正确;
D.O2能氧化Fe2+且不引入杂质,故D正确;
故选CD;
(2)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质,则可用CuO 或Cu(OH)2或CuCO3或Cu2(OH)2CO3 .
故答案为:C.
点评 本题考查较为综合,涉及物质的分离、提纯和制备,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及题给信息,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.在中和反应的反应热测定试验中,使用下列物质或仪器的目的不是为了减少实验误差的是( )
| A. | 大小烧杯间填满碎纸片 | B. | 大烧杯上用硬纸板作盖板 | ||
| C. | 使用环形玻璃搅拌棒 | D. | 分别使用两个量筒量取酸液和碱液 |
5.以苯酚为原料合成对羟基苯乙酮的原理如图:
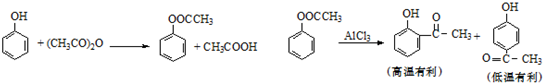
(1)乙酸苯酚酯制备:
将9.4g苯酚溶解在60mL10%的氢氧化钠溶液中,加入30g碎冰块,然后加入13.0g乙酸酐,搅拌5min.将反应后混合物倾入分液漏斗中,加入约4mL CCl4.将有机相用试剂X和水洗涤然后无水CaCl2干燥,蒸馏收集193-197℃馏分.
①用碎冰块代替水可能的原因是:该反应是放热反应,碎冰温度低有利于酯的生成.
②乙酸酐过量的目的是:提高苯酚的转化率.
③有机相先用试剂X洗涤,X可能是Na2CO3或NaHCO3溶液.
(2)对羟基苯乙酮的制备:
将乙酰苯酚6.8g,硝基苯20mL 放在三口烧瓶中,搅拌下加入无水AlCl3 11g(此时放热),加完后控制合适的温度,维持一定时间.然后冷却,倾入冰水中,用6mol/L HCl酸化分出硝基苯层,水层用氯仿萃取,蒸出氯仿得粗品.
①硝基苯的作用是作溶剂.
②乙酸苯酚重排为对羟基苯乙酮反应条件对收率的影响关系如表
适宜的温度是20~25;反应时间是180min.

(1)乙酸苯酚酯制备:
将9.4g苯酚溶解在60mL10%的氢氧化钠溶液中,加入30g碎冰块,然后加入13.0g乙酸酐,搅拌5min.将反应后混合物倾入分液漏斗中,加入约4mL CCl4.将有机相用试剂X和水洗涤然后无水CaCl2干燥,蒸馏收集193-197℃馏分.
①用碎冰块代替水可能的原因是:该反应是放热反应,碎冰温度低有利于酯的生成.
②乙酸酐过量的目的是:提高苯酚的转化率.
③有机相先用试剂X洗涤,X可能是Na2CO3或NaHCO3溶液.
(2)对羟基苯乙酮的制备:
将乙酰苯酚6.8g,硝基苯20mL 放在三口烧瓶中,搅拌下加入无水AlCl3 11g(此时放热),加完后控制合适的温度,维持一定时间.然后冷却,倾入冰水中,用6mol/L HCl酸化分出硝基苯层,水层用氯仿萃取,蒸出氯仿得粗品.
①硝基苯的作用是作溶剂.
②乙酸苯酚重排为对羟基苯乙酮反应条件对收率的影响关系如表
| 反应温度/℃ | 反应时间(min) | 收率 |
| 30~35 | 180 | 10.0 |
| 20~25 | 60 | 18.0 |
| 20~25 | 120 | 26.0 |
| 20~25 | 180 | 58.5 |
2.在一定条件下,对于密闭容器中的反应:N2+3H2?2NH3,下列说法正确的是( )
| A. | 增加N2的量,可以加快反应速率 | |
| B. | 当N2和H2全部转化为NH3时,反应才达到最大限度 | |
| C. | 达到平衡时,H2和NH3的浓度比一定为3:2 | |
| D. | 分别用N2和NH3来表示该反应的速率时,数值大小相同 |

 (1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.
(1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.


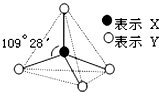 甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同.
甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同.