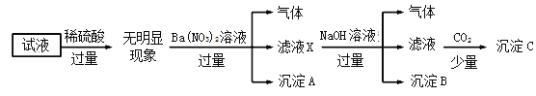
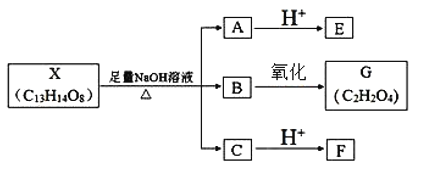
题目内容
【题目】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)E元素原子的价电子排布式是______,在元素周期表中位置是_____,其最高价氧化物的化学式是__________。
(2)C基态原子的电子排布图为_____,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于_____键(填“σ”或“π”)。
(3)当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是_______。
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的电负性由大到小的顺序是_____(用元素符号表示)。
【答案】3d54s2 第四周期第ⅦB族 Mn2O7 ![]() σ SiO2+2OH-=SiO32- +H2O O>P>Si>Li
σ SiO2+2OH-=SiO32- +H2O O>P>Si>Li
【解析】
元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1,A位于IA族,可能为H、Li、Na、K;B元素的原子价电子排布式为ns2np2,B位于ⅣA族,B可能为C或Si;C元素位于第二周期且原子中p能级与s能级电子总数相等,电子排布为1s22s22p4,C为O元素;D元素原子的M能层的p能级中有3个未成对电子,电子排布为1s22s22p63s23p3,D为P元素;E元素原子有五个未成对电子,E位于第四周期,电子排布应为1s22s22p63s23p63d54s2,E为Mn,据此解答。
元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1,A位于IA族,可能为H、Li、Na、K;B元素的原子价电子排布式为ns2np2,B位于ⅣA族,B可能为C或Si;C元素位于第二周期且原子中p能级与s能级电子总数相等,电子排布为1s22s22p4,C为O元素;D元素原子的M能层的p能级中有3个未成对电子,电子排布为1s22s22p63s23p3,D为P元素;E元素原子有五个未成对电子,E位于第四周期,电子排布应为1s22s22p63s23p63d54s2,E为Mn。
(1)E为Mn元素,Mn元素原子的电子排布应为1s22s22p63s23p63d54s2,则其价电子排布式是3d54s2,该元素在元素周期表中位置是第四周期第ⅦB族,最高化合价为+7价,则Mn元素的最高价氧化物的化学式是Mn2O7;
(2)C为O元素,基态O原子的核外电子总数为8,其电子排布图为![]() ;根据上述推断,A位于IA族,可能为H、Li、Na、K;若A为非金属元素,即A为H元素,则按原子轨道的重叠方式,A与C形成的化合物H2O、H2O2中只含共价单键,共价键属于σ键;
;根据上述推断,A位于IA族,可能为H、Li、Na、K;若A为非金属元素,即A为H元素,则按原子轨道的重叠方式,A与C形成的化合物H2O、H2O2中只含共价单键,共价键属于σ键;
(3)n=3时,B为Si元素,O、Si两种元素形成的化合物为SiO2,SiO2是酸性氧化物,与NaOH溶液反应生成Na2SiO3和H2O,该反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;
(4)若A元素的原子最外层电子排布为2s1,A为Li元素,B元素的原子价电子排布为3s23p2,B为Si元素,C为O元素、D为P元素,由于元素的非金属性越强,其第一电离能越大,P的3p电子半满为稳定结构,但第一电离能仍小于O元素,则A、B、C、D四种元素的第一电离能由大到小的顺序是O>P>Si>Li。

【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
【题目】我国在南海北部神弧海域进行的可燃冰试采成功,这标志着我国成为全球第一个实现了在海域可燃冰试开采中获得连续稳定产气的国家。可燃冰主要成分是甲烷,可以用作燃料和制氢原料。甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整两个过程。发生的主要反应如下:
化学方程式 | 焓变ΔH/(kJ·mol-1) | 活化能Ea/(kJ·mol-1) | |
甲烷氧化 | CH4(g)+2O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | Ⅰ.CH4(g)+H2O(g) | +206.2 | 240.1 |
Ⅱ.CH4(g)+2H2O(g) | +165 | 243.9 |
下列说法不正确的是
A.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
B.反应Ⅱ逆反应活化能Ea=78.9kJ·mol-1
C.初始阶段:甲烷氧化的速率大于甲烷蒸气重整的速率
D.甲烷自热重整方法的突出优点是能量循环利用