题目内容
7.如图是中学化学常用的实验仪器: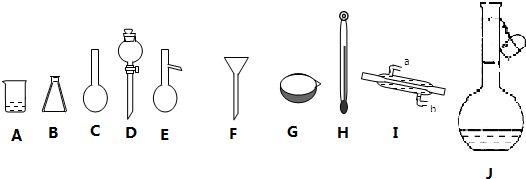
(1)填写以下仪器的名称:C圆底烧瓶,G蒸发皿.
(2)分离由乙醇和甘油组成的混合物需要用到的上述仪器有B、E、H、I(填序号,下同)(已知乙醇和甘油互溶,沸点:乙醇78.5℃,甘油259℃);标有使用温度的仪器是J.
(3)填写除去下列混合物中的杂质需要的操作方法(括号内为杂质):
NaCl溶液(泥沙)过滤; NaCl溶液(汽油)分液;氯化钠固体(碘)升华.
分析 (1)根据仪器的结构特点写出C、G的名称;
(2)分离乙醇和甘油组成的混合物的方法为蒸馏,根据蒸馏操作方法判断使用的仪器;温度影响溶液体积,则容量瓶上标有温度;
(3)通过过滤除去溶液中难溶物,分离不溶的液体采用分液操作,碘单质易升华,可据此除去氯化钠中的碘单质.
解答 解:(1)根据图示可知,仪器C为圆底烧瓶,仪器G为蒸发皿,
故答案为:圆底烧瓶、蒸发皿;
(2)乙醇和甘油互溶,可根据二者的沸点相差较大采用蒸馏法分离,蒸馏操作所以的仪器有:蒸馏烧瓶、锥形瓶、冷凝管、温度计等,所以需要用到的上述仪器有B、E、H、I;由于温度影响溶液体积,所以配制溶液时必须在一定温度下进行,故容量瓶上标有温度,
故答案为:B、E、H、I;J;
(3)NaCl溶液(泥沙):泥沙不溶于水,可通过过滤操作分离出氯化钠溶液的中的泥沙;
NaCl溶液(汽油):汽油不溶于氯化钠溶液,可通过分液操作分离出氯化钠溶液中的汽油;
氯化钠固体(碘):氯化钠比较稳定,而碘单质易升华,可通过升华除去氯化钠固体中的碘单质,
故答案为:过滤;分液;升华.
点评 本题考查了化学实验装置的综合应用,题目难度中等,明确常见仪器的构造及使用方法为解答关键,注意掌握物质分离与提纯的方法及应用,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
2.C原子的质量为bg,A原子质量为ag,阿伏伽德罗常数为NA,则A的相对原子质量为( )
| A. | $\frac{12a}{b}$ | B. | $\frac{12b}{a}$ | C. | NA•a | D. | 12NA |
2.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 某溶液中加入氢氧化钠溶液生成蓝色沉淀,一定有Cu2+ |
12.下列离子方程式正确的是( )
| A. | 向100 mL 0.1 mol•L-1的FeSO4溶液中加入0.01 mol Na2O2固体:2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 在硫酸工业中,对尾气中的SO2用过量的氨水吸收的反应:NH3•H2O+SO2═NH${\;}_{4}^{+}$+HSO${\;}_{3}^{-}$ | |
| D. | 向20 mL 0.5 mol•L-1 FeBr2溶液中通入448 mL Cl2(标准状况):2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
16.已知:苯的密度比水小,不溶于水,与CCl4同属于常用有机溶剂.现将碘水与苯充分混合后静置,下列说法正确的是( )
| A. | 溶液分层,上层无色,下层紫红色 | B. | 溶液不分层 | ||
| C. | 溶液分层,上层紫红色,下层无色 | D. | 溶液分层,上层黄色,下层紫红色 |
17.对于合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,下列说法正确的是( )
| A. | 若起始加入2molN2和6molH2发生反应,则平衡时N2和H2的转化率相同 | |
| B. | 该反应采用高温条件,有利于提高NH3的产率,从而提高生产效率 | |
| C. | 若起始加入2molN2和6molH2发生反应,平衡时测得反应共放热46kJ,则N2的平衡转化率为50% | |
| D. | 若平衡时保持其它条件不变,压缩容器体积,则平衡正向移动,N2的浓度减小,NH3的浓度增大 |