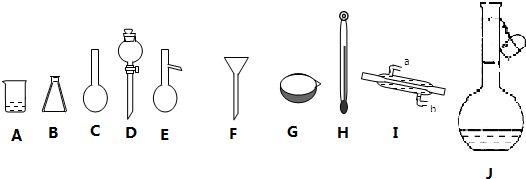题目内容
12.下列离子方程式正确的是( )| A. | 向100 mL 0.1 mol•L-1的FeSO4溶液中加入0.01 mol Na2O2固体:2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 在硫酸工业中,对尾气中的SO2用过量的氨水吸收的反应:NH3•H2O+SO2═NH${\;}_{4}^{+}$+HSO${\;}_{3}^{-}$ | |
| D. | 向20 mL 0.5 mol•L-1 FeBr2溶液中通入448 mL Cl2(标准状况):2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
分析 A.发生氧化还原反应,反应生成硫酸钠、氢氧化铁;
B.至SO42-恰好沉淀完全,以1:2反应,生成硫酸钡和偏铝酸钾;
C.用过量的氨水吸收,反应生成亚硫酸铵;
D.n(FeBr2)=0.02L×0.5 mol•L-1=0.01mol,n(Cl2)=$\frac{0.448}{22.4L/mol}$=0.02mol,由电子守恒可知,亚铁离子、溴离子全部被氧化.
解答 解:A.向100 mL 0.1 mol•L-1的FeSO4溶液中加入0.01 mol Na2O2固体的离子反应为4Fe2++4Na2O2+6H2O═8Na++4Fe(OH)3↓+O2↑,故A错误;
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全的离子的反应为Al3++2SO42-+2Ba2++4OH-═AlO2-+3BaSO4↓+2H2O,故B错误;
C.在硫酸工业中,对尾气中的SO2用过量的氨水吸收的反应的离子反应为2NH3•H2O+SO2═2NH4++SO32-,故C错误;
D.n(FeBr2)=0.02L×0.5 mol•L-1=0.01mol,n(Cl2)=$\frac{0.448}{22.4L/mol}$=0.02mol,由电子守恒可知,亚铁离子、溴离子全部被氧化,则离子反应为2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应书写方法为解答的关键,侧重与量有关的反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度较大.

练习册系列答案
相关题目
6.设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 0.1mo1•L-1MgCl2溶液中含C1一数为0.2 NA | |
| B. | 标准状况下,22.4L的CCl4中含CCl4分子数为NA | |
| C. | 0.1molNa2O2与足量的CO2完全反应转移电子数目为0.1NA | |
| D. | 10mL5mol•L-1(NH4)2CO3溶液中含有N原子数目小于0.1 NA |
17.下列化学实验操作或事故处理方法不正确的是( )
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 | |
| C. | 酒精灯着火时可用沙子扑灭 | |
| D. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 |
4.Na2O2是一种既有氧化性、又有还原性的物质,当Na2O2与某物质Q发生反应并且有氧气生成时,下列有关说法正确的是( )
| A. | Q一定是氧化剂 | |
| B. | 当有1 mol O2生成时转移电子4 mol | |
| C. | O2一定是氧化产物 | |
| D. | Na2O2不可能发生还原反应 |
2.下列有关叙述错误的是( )
| A. | 化学反应均伴随着能量的变化 | |
| B. | 需要加热才能发生的反应不一定是吸热反应 | |
| C. | 物质的化学能可以在一定条件下转化为热能、电能为人类利用 | |
| D. | 吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 |
 已知:溴苯的熔点为?30.8℃,沸点156℃.实验室用苯和液溴制取溴苯的装置如图:
已知:溴苯的熔点为?30.8℃,沸点156℃.实验室用苯和液溴制取溴苯的装置如图: .;
.;