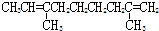题目内容
17.对于合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,下列说法正确的是( )| A. | 若起始加入2molN2和6molH2发生反应,则平衡时N2和H2的转化率相同 | |
| B. | 该反应采用高温条件,有利于提高NH3的产率,从而提高生产效率 | |
| C. | 若起始加入2molN2和6molH2发生反应,平衡时测得反应共放热46kJ,则N2的平衡转化率为50% | |
| D. | 若平衡时保持其它条件不变,压缩容器体积,则平衡正向移动,N2的浓度减小,NH3的浓度增大 |
分析 A.根据转化率=$\frac{转化量}{起始量}$判断;
B.根据N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol为气体体积减小的放热反应;
C.根据N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol则平衡时测得反应共放热46kJ即消耗0.5mol氮气,据此计算;
D.其它条件不变,压缩容器体积即增大压强,则平衡正向移动,但体积减小,N2的浓度仍然增大,NH3的浓度增大.
解答 解:A.因为转化率=$\frac{转化量}{起始量}$,又起始加入2molN2和6molH2发生反应,转化量也是1:3转化,所以平衡时N2和H2的转化率相同,故A正确;
B.因为N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol为气体体积减小的放热反应,所以低温条件,有利于提高NH3的产率,从而提高生产效率,故B错误;
C.因为N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol则平衡时测得反应共放热46kJ即消耗0.5mol氮气,所以N2的平衡转化率为$\frac{0.5}{2}$×100%=25%,故C错误;
D.其它条件不变,压缩容器体积即增大压强,则平衡正向移动,但体积减小,N2的浓度仍然增大,NH3的浓度增大,故D错误;
故选A.
点评 本题考查了化学平衡转化率的判断,平衡移动原理等知识点,难度不大,明确外界条件对平衡的影响是解本题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列有关化学反应速率的说法中,正确的是( )
| A. | 铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 等质量的锌片分别与同体积、同物质的量浓度的盐酸、硫酸反应,反应速率不相等 | |
| C. | SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 | |
| D. | 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 |
2.下列有关叙述错误的是( )
| A. | 化学反应均伴随着能量的变化 | |
| B. | 需要加热才能发生的反应不一定是吸热反应 | |
| C. | 物质的化学能可以在一定条件下转化为热能、电能为人类利用 | |
| D. | 吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 |
6.下列反应中生成物总能量高于反应物总能量的是( )
| A. | NH4Cl晶体受热分解 | B. | 木炭燃烧 | ||
| C. | 钠与水反应 | D. | 酸碱中和反应 |
7.通过书写化学方程式举出反例,证明下列说法不正确.
| 氧化反应一定属于化合反应 | CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O |
| 生成盐和水的反应一定是中和反应 | Ca(OH)2+CO2═CaCO3↓+H2O |
| 只有在加热或高温条件下才能冶炼出金属 | Fe+CuSO4═FeSO4+Cu |
 如图是初中化学中常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体;乙和丁为黑色固体.
如图是初中化学中常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体;乙和丁为黑色固体. .
.