题目内容
13.在600K时,反应2NO+O2═2NO2实验数据如下:| 初始浓度/(mol•L-1) | 初始速率/mol•L-1s-1 | |
| c(NO) | c(O2) | |
| 0.010 | 0.010 | 2.5×10-3 |
| 0.010 | 0.020 | 5.0×10-1 |
| 0.030 | 0.020 | 4.5×10-2 |
分析 设速率方程式v=kc(NO)mc(O2)n,代入相关数据,求解n=1,k=2.5×103;m=2.再根据反应级数等于速率方程中各物浓度的指数的总和,求出反应总级数为3.
解答 解:设反应速率方程为v=kc(NO)mc(O2)n,代入表格中提供的数据:v1=kc(0.01)mc(0.01)n ;v2=kc(0.01)mc(0.02)n;v3=kc(0.03)mc(0.02)n;解得n=1,k=2.5×103;m=2;
所以反应速率方程式为:v=2.5×103c(NO)2c(O2);
反应级数,是化学动力学基本参数,化学反应的速率方程中各物浓度的指数称为各物的分级数,所有指数的总和称为反应总级数,用n表示.所以,反应级数=2+1=3.
答:反应速率方程式为v=2.5×103c(NO)2c(O2);反应级数为3.
点评 本题属于反应速率中的计算,把握相关知识点,注意计算的准确性即可.

练习册系列答案
相关题目
3.下列有关说法正确的是( )
| A. | 第ⅠA族元素都是典型的金属元素 | |
| B. | 第三周期的元素的原子核外都有三个电子层 | |
| C. | F、Cl、O、N四种元素都是第ⅦA族的元素 | |
| D. | 原子的最外层有两个电子的元素都在第ⅡA族 |
4. 金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )
金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )
 金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )
金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )| A. | △H<0△S<0 | B. | △H>0△S<0 | C. | △H<0△S>0 | D. | △H>0△S>0 |
8.根据下列操作及现象,所得结论正确的是( )
| 序号 | 操作及现象 | 结论 |
| A | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| B | 将0.1mol•L-1氨水稀释成0.01mol•L-1,测得pH由11.1变成 10.6 | 稀释后NH3•H2O的电离程度减小 |
| C | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度:CO32->HCO3- |
| D | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| A. | A | B. | B | C. | C | D. | D |
18.从废钒催化剂(主要成分为V2O5、VOSO4、K2SO4、SiO2等)中回收V2O5的一种工艺流程示意图如下,请回答下列问题:
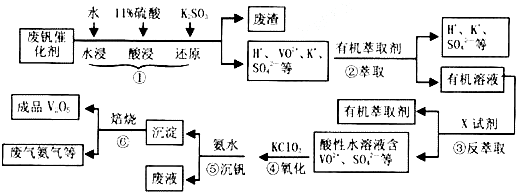
(1)步骤①中废渣的主要成分是SiO2,③中X试剂为H2SO4.
(2)②、③的变化过程可简化为R2(SO4)n (水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂).为提高②中萃取百分率,应采取的措施是加入碱中和硫酸使平衡正移.
(3)请完成④中反应的离子方程式:
ClO3-+6VO2++6H+═6VO3++1Cl-+H2O.
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产时⑤中加入氨水,调节溶液的最佳pH值为1.7~1.8.
(5)该工艺流程中,可以循环利用的物质有有机萃取剂、氨气.

(1)步骤①中废渣的主要成分是SiO2,③中X试剂为H2SO4.
(2)②、③的变化过程可简化为R2(SO4)n (水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂).为提高②中萃取百分率,应采取的措施是加入碱中和硫酸使平衡正移.
(3)请完成④中反应的离子方程式:
ClO3-+6VO2++6H+═6VO3++1Cl-+H2O.
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(5)该工艺流程中,可以循环利用的物质有有机萃取剂、氨气.
3.下列说法正确的是( )
| A. | 2015年2月15日起,湖南省环保厅按照《环境空气质量标准》(GB3095-2012)发布了全省14市州政府所在地城市空气质量排名,主要污染物包括PM2.5、PM10、O3、CO2、SO2和NO2等6项指标 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | 明矾水解产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| D. | 将实验室的废酸液和废碱液中和后再排放符合“绿色化学”的要求 |
4.下列叙述中正确的是( )
| A. | 周期表中第VA族元素的最高价氧化物对应水化物的化学式均为H3RO4 | |
| B. | O2−2与S2-具有相同的质子数和电子数 | |
| C. | 氕、氘、氚分别与O原子形成的水H2O、D2O、T2O的化性质不同 | |
| D. | 形成离子键的阴阳离子间只存在静电吸引力 |
 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题: