题目内容
4. 金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )
金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )| A. | △H<0△S<0 | B. | △H>0△S<0 | C. | △H<0△S>0 | D. | △H>0△S>0 |
分析 根据方程式中各物质的聚集状态判断反应的熵变,根据反应过程中反应物和生成物能量高低判断反应的焓变.
解答 解:SnO2(s)+2C(s)═Sn(s)+2CO(g),该反应生成物气体系数大,混乱度大,所以是熵增加的反应,故:△S>0;
从图中可知,反应物能量低,生成物能量高,该反应是吸热反应,故:△H>0;
故选D.
点评 本题考查了反应的焓变和熵变,题目难度不大,平时训练时注意提高分析图象的能力的培养.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.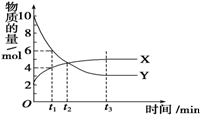 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.下列叙述中正确的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.下列叙述中正确的是( )
 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.下列叙述中正确的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | B. | t1时,Y的浓度是X浓度的1.5倍 | ||
| C. | t2时,正、逆反应速率相等 | D. | t3时,逆反应速率大于正反应速率 |
12.A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如下表:
请回答下列问题:
(1)E在元素周期表中的位置第四周期第Ⅷ族;D原子结构示意图是
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同)S2->O2->Na+,B、D的简单气态氢化物中稳定性较大的是H2O
(3)B、C的单质按物质的量比1:2形成的化合物中化学键的类型为离子键、好几件;该化合物电子式为 .
.
(4)E的一种具有磁性的黑色晶体发生铝热反应的化学方程式是3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3.
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 焰色反应呈黄色 |
| D | 与B同主族的短周期元素 |
| E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
(1)E在元素周期表中的位置第四周期第Ⅷ族;D原子结构示意图是

(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同)S2->O2->Na+,B、D的简单气态氢化物中稳定性较大的是H2O
(3)B、C的单质按物质的量比1:2形成的化合物中化学键的类型为离子键、好几件;该化合物电子式为
 .
.(4)E的一种具有磁性的黑色晶体发生铝热反应的化学方程式是3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3.
19.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | 元素Z、W的简单离子的电子层结构不同 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
9.下列叙述I和II均正确并有因果关系的是( )
| 选项 | 叙述I | 叙述II |
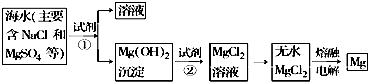
| A | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| B | AgCl难溶于酸 | 用盐酸和AgNO3溶液检验Cl- |
| C | Ba(OH)2易溶于水 | 可配制1.0mol?L-1的Ba(OH)2溶液 |
| D | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
16.下列水溶液中能大量共存的一组离子是( )
| A. | K+、Al3+、CO32-、Cl- | B. | Na+、H+、SO42-、SiO32- | ||
| C. | H+、NH4+、SO42-、I- | D. | H+、Fe2+、Cl-、ClO- |
13.在600K时,反应2NO+O2═2NO2实验数据如下:
写出反应速率方程式和反应级数.
| 初始浓度/(mol•L-1) | 初始速率/mol•L-1s-1 | |
| c(NO) | c(O2) | |
| 0.010 | 0.010 | 2.5×10-3 |
| 0.010 | 0.020 | 5.0×10-1 |
| 0.030 | 0.020 | 4.5×10-2 |
15.实验室常用锌与稀硫酸反应制取H2.欲使产生H2的速率加快,下列措施可行的是( )
| A. | 加水稀释 | B. | 加少量NaOH溶液 | C. | 降低温度 | D. | 锌片改为锌粉 |