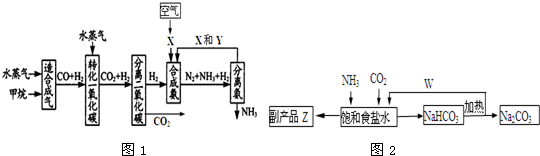
题目内容
20.某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2,和Zn(干电池原料).流程如下: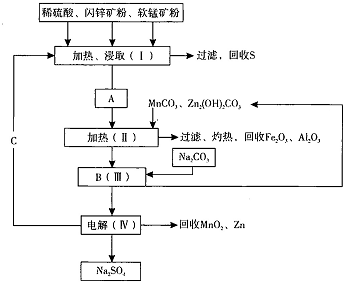
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3,Al2(SO4)3的混合液.
②IV中的电解反应式为MnSO4+ZnSO4+2H2O $\stackrel{电解}{→}$MnO2+Zn+2H2SO4.
(1)A中属于还原产物的是MnSO4.
(2)加入MnCO3、Zn2(OH)2CO3的作用是调节溶液的pH,使Fe3+和Al3+生成沉淀:C的化学式是H2SO4.
(3)该生产中除得到Na2SO4、S等副产品外,还可得到的副产品是硫、氧化铁、氧化铝.
(4)副产品S可用于制硫酸,转化过程是:S→SO2→SO3→H2SO4.写出第二步转化的化学方程式O2+2SO2$?_{△}^{催化剂}$2SO3.
(5)要从Na2SO4溶液中得到芒硝( Na2SO4•10H2O),需进行的操作有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿投料的质量比大约是1.03:1.
分析 分析流程软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)加入硫酸酸溶,加热酸浸过滤得到A为MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的酸性混合液,加热过滤回收Fe2O3,Al2O3,加入碳酸钠沉淀锰离子和锌离子,得到滤液电解得到 二氧化锰、锌和硫酸钠,
(1)比较信息①A与软锰矿中元素化合价的变化可知,A中还原产物为MnSO4;
(2)由工艺流程可知,A中加入MnCO3、Zn2(OH)2CO3,A中的Fe3+、Al3+,经过一系列操作转化为氧化铁、氧化铝;操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用;
(3)根据流程图不难得出副产物有硫、氧化铁、氧化铝;
(4)制硫酸工业中的第二步是用SO2催化氧化生成SO3;
(5)从溶液中获得固体物质,需蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(6)设软锰矿、闪锌矿的质量分别为x、y,根据②可知MnO2、Zn的物质的量之比为1:1,据此列放出计算x:y的值.
解答 解:分析流程软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)加入硫酸酸溶,加热酸浸过滤得到A为MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的酸性混合液,加热过滤回收Fe2O3,Al2O3,加入碳酸钠沉淀锰离子和锌离子,得到滤液电解得到 二氧化锰、锌和硫酸钠,
(1)比较信息①A与软锰矿中元素化合价的变化可知,Mn元素化合价由+4价降低为+2价,所以A中还原产物为MnSO4,
故答案为:MnSO4;
(2)由工艺流程可知,MnCO3、Zn2(OH)2CO3的作用就是调节pH,使Fe3+、Al3+沉淀完全,Fe3+、Al3+沉淀容易形成胶体,不利于氢氧化铁、氢氧化铝沉降,Ⅱ操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用,
故答案为:调节溶液的pH,使Fe3+和 Al3+生成沉淀;H2SO4;
(3)根据流程图可知,副产物有硫、氧化铁、氧化铝,
故答案为:硫、氧化铁、氧化铝;
(4)制硫酸工业中的第二步是用SO2催化氧化生成SO3,反应方程式为O2+2SO2$?_{△}^{催化剂}$2SO3,
故答案为:O2+2SO2$?_{△}^{催化剂}$2SO3;
(5)从溶液中获得固体物质,需蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:冷却结晶;
(6)设软锰矿、闪锌矿的质量分别为xg、yg,根据②可知MnO2、Zn的物质的量之比为1:1,则:$\frac{0.7xg}{87g/mol}$:$\frac{0.8yg}{97g/mol}$=1:1,解得x:y=1.03:1,
故答案为:1.03:1.
点评 本实验的目的是制备二氧化锰与锌,因而需要把氧化铝、铁元素、硫元素除去.据此考查学生对工艺流程的理解、物质性质、氧化还原反应、分离提纯基本操作、化学计算等,难度中等,关键是掌握整个制备流程原理,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.

| A. | 在pH=1溶液中:NH4+、K+、HS-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- | |
| C. | 使酚酞试液变红的溶液中:Na+、Cl-、SO${\;}_{4}^{2-}$、Fe3+ | |
| D. | 无色透明的水溶液中:K+、Ba2+、I-、NO${\;}_{3}^{-}$ |
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取最后一次的洗涤滤液1~2mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化.
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪 器 及 装 置 图 |  | 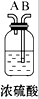 |  |  | 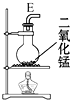 |  |
(2)装置②的作用是干燥氯气;
(3)装置④的作用是除去氯气中的氯化氢;
(4)装置⑥中发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)实验开始时,应首先检验装置的检验装置气密性,实验结束时,应先熄灭①处的酒精灯.
(6)在装置⑤的烧瓶中,发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
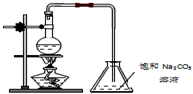 如图为制取乙酸乙酯的实验装置图,请回答下列问题:
如图为制取乙酸乙酯的实验装置图,请回答下列问题:(1)实验室制取乙酸乙酯的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)欲提高乙酸的转化率,可采取的措施有乙醇过量、及时分离出乙酸乙酯等.
(3)若用图所示的装置来制取少量的乙酸乙酯,产率往往偏低,其原因可能是:原料来不及反应就被蒸出,温度过高,发生了副反应,冷凝效果不好,部分产物挥发了等.
(4)实验时可观察到锥形瓶中有气泡产生,用离子方程式表示产生气泡的原因:
2CH3COOH+CO32-→2CH3COO-+CO2↑+H2O.
(5)此反应以浓硫酸作为催化剂,可能会造成产生大量酸性废液,催化剂重复使用困难等问题.现代研究表明质子酸离子液体可作此反应的催化剂,实验数据如下表所示(乙酸和乙醇以等物质的量混合):
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.7 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
根据表中数据,下列C(填编号),为该反应的最佳条件.
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h.