题目内容
5.重庆有丰富的天然气资源.以天然气为原料合成氨的主要步骤如图1所示(图中某些转化步骤及生成物未列出),请填写下列空白: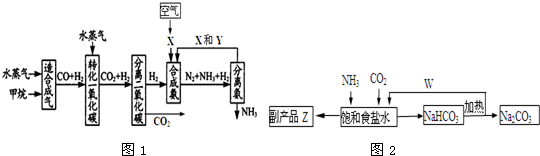
(1)已知2mol甲烷与水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了akJ热量,该反应的热化学方程式是CH4(g)+H2O (g)═CO(g)+3H2(g)△H=+$\frac{a}{2}$ kJ/mol.
(2)如图1中X为N2,Y为H2(填化学式);常用K2CO3溶液吸收分离出的CO2,其离子方程式为CO3-+CO2+H2O=2HCO3-
(3)在合成氨工业中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来.请运用化学平衡的观点说明采取该措施的理由:减小生成物浓度,促进平衡正向移动.
(4)联合制碱法中,合成氨产生的NH3与CO2通入饱和食盐水最终可制得纯碱,如图2所示
①应先向食盐水通足量NH3气体(写化学式,后同);副产品Z为NH4Cl,可用作氮肥;W为CO2.
②若生产 Na2CO3 5.3吨,理论上至少可制得副产品Z5.35吨.
分析 水蒸气和甲烷生成一氧化碳和氢气,一氧化碳和氢气气体通过水蒸气转化为二氧化碳和氢气,利用空气制备氮气,氢气和氮气合成氨,分离出氨气促进平衡正向进行,提高氨气的产率,循环使用氮气和氢气的混合气体,提高原料利用率;
在联合制碱法中,合成氨产生的NH3与CO2通入饱和食盐水,发生反应NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3,过滤得到碳酸氢钠晶体,滤液为副产品氯化铵溶液,碳酸氢钠分解最终可制得纯碱,氯化铵可以提纯后制的氮肥,
(1)2mol甲烷和0.5mol水蒸气完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,则反应物各1mol完全反应吸收$\frac{a}{2}$KJ热量,结合热化学方程式书写方法写出热化学方程式;
(2)依据分析可知,合成氨是氮气和氢气在催化剂作用下高温高压反应生成氨气,用K2CO3溶液吸收分离出的CO2生成碳酸氢钠;
(3)将生成的氨从混合气体中及时分离出来,促进平衡正向进行,增大氨气的产量;
(4)①二氧化碳在水溶液中溶解度小,先通氨气,使溶液呈碱性,有利于二氧化碳的溶解,反应的副产品氯化铵可作农业生产的化肥;
②反应的化学方程式为:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,依据定量关系计算副产品氯化铵的质量.
解答 解:(1)2mol甲烷和0.5mol水蒸气完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,则反应物各1mol完全反应吸收$\frac{a}{2}$KJ热量,结合热化学方程式书写方法写出热化学方程式:CH4(g)+H2O (g)═CO(g)+3H2(g)△H=+1/2a kJ/mol,
故答案为:CH4(g)+H2O (g)═CO(g)+3H2(g)△H=+$\frac{a}{2}$ kJ/mol;
(2)依据分析可知,合成氨是氮气和氢气在催化剂作用下高温高压反应生成氨气,图1中X为N2,Y为H2,用K2CO3溶液吸收分离出的CO2生成碳酸氢钠,反应的离子方程式为:CO3-+CO2+H2O=2HCO3-,
故答案为:N2;H2; CO3-+CO2+H2O=2HCO3-;
(3)将生成的氨从混合气体中及时分离出来,减少生成物的浓度促进平衡正向进行,增大氨气的产量,
故答案为:减小生成物浓度,促进平衡正向移动;
(4)①二氧化碳在水溶液中溶解度小,先通氨气使溶液呈碱性,有利于二氧化碳的溶解,反应的化学方程式为:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3,联合制碱法中,合成氨产生的NH3与CO2通入饱和食盐水最终可制得纯碱,副产品氯化铵可作农业生产的化肥,W为碳酸氢钠分解生成的二氧化碳气体,通入饱和食盐水循环使用,
故答案为:NH3,NH4Cl,氮肥,CO2;
②NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
得到 2NH4Cl~Na2CO3
2×53.5 106
m 5.3t
m=5.35t
故答案为:5.35.
点评 本题考查了学生对工艺流程的理解,热化学方程式,物质的分离等,难度中等,关键是掌握整个制备流程原理,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案| A. | 加热 溶解 过滤 结晶 | B. | 溶解 过滤 蒸发 结晶 | ||
| C. | 加热 溶解 蒸发 过滤 | D. | 溶解 过滤 蒸馏 蒸发 |
 向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )
向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )| A. | 硝酸钙与硫酸钾的混合液 | B. | 氯化钡与碳酸钠的混合液 | ||
| C. | 硫酸镁与氢氧化钾的混合液 | D. | 氯化铝与硝酸钠的混合液 |
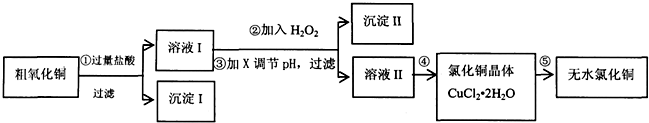
(1)步骤①中氧化铜与盐酸反应的离子方程式:CuO+2H+=Cu2++H2O.
(2)步骤②中加入H2O2的目的:将Fe2+氧化成Fe3+,沉淀Ⅱ的化学式为:Fe(OH)3.
(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
A.NaOH B.CuO C.Cu(OH)2 D.NH3•H2O
(4)步骤④的操作是蒸发浓缩、冷却结晶,过滤、洗涤、干燥.为得到无水CuCl2,步骤⑤需在干燥的HCl气流中加热CuCl2•2H2O,原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.

| A. | 先通二氧化碳、后通氨气、效果相同 | B. | 生成1mol(NH4)2SO4至少消耗2molNH3 | ||
| C. | CO2可被循环使用 | D. | 往甲中通CO2有利于制备(NH4)2SO4 |
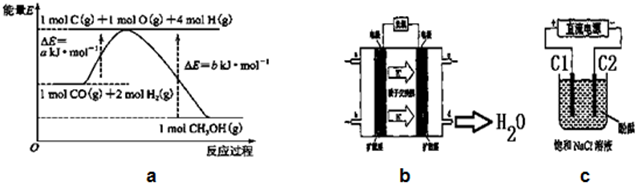
(1)写出合成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)KJ/mol.
(2)实验室在1L的密闭容器中进行模拟合成实验.将1mol CO和2mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(3)在500℃达到平衡时,平衡常数K=25.
(4)在另一体积不变的密闭容器中,充入1.2mol CO和2.0mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半.计算该条件下H2的转化率为80%.
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇.使用铜基催化剂后,该反应中a的大小变化对反应热△H有无影响,无影响.(填“有影响”或“无影响”)
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图b所示.请写出从C口通入O2发生的电极反应式O2+4e-+4H+=2H2O.
(7)用上述电池做电源,用图c装置电解饱和食盐水(C1、C2均为石墨电极).
①该反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
②电解开始后在电极C2的周围(填“C1”或“C2”)先出现红色.

实验药品:铜,铁,镁,0.5mol/L H2SO4,2mol/L H2SO4,18.4mol/L H2SO4
Ⅰ.甲同学研究的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的 2 mol/L的硫酸于试管 | 反应速率:镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Mg.
(2)甲同学的实验目的是探究反应物本身的性质对反应速率的影响;要得出正确的实验结论,还需控制的实验条件是温度相同.
Ⅱ.乙同学为了更精确的研究浓度对反应速率的影响,利用右图所示装置进行实验,
(3)乙同学在实验中应该测定的数据是一定时间内产生气体的体积(或产生一定体积的气体所需的时间).
(4)乙同学完成该实验应选用的实验药品镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4.
(5)图中仪器A的名称是分液漏斗,检验该装置气密性的方法是按住注射器活塞不动,向分液漏斗中倒水,液面高度不变,说明装置气密性良好.
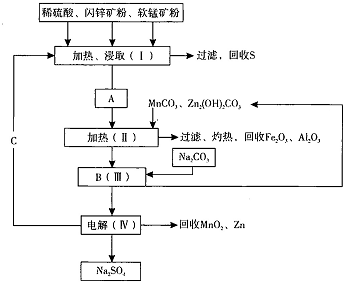
 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应: