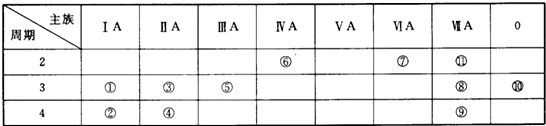
题目内容
8.有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:①铜与浓硫酸加热直接反应,即Cu→CuS04
②将铜加到热的稀硫酸中并通入空气来制备硫酸铜,即由Cu→CuO→CuSO4,试回答:
(1)写出方案①的化学反应方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
这两种方案,你认为哪一种方案比较合理?②合理.(答编号),理由是无污染性气体生成,原料消耗少.
(2)实验室采用方案①铜与浓硫酸加热直接反应制取硫酸铜时,会有气体产生,若将产生的气体通入盛有品红溶液的试管中,看到的现象是品红溶液褪色;
若将Cl2通入品红溶液中也能看到同样的现象,如果不从气体颜色上去判断,到底是SO2还是Cl2导致了上述现象的发生应怎样操作才能做出判断:对褪色的溶液加热,若恢复红色则是二氧化硫的漂白性,若加热不能恢复溶液颜色,证明为氯气导致的品红溶液褪色
该气体和氯气(Cl2)分别通入盛有石蕊试液的试管中,看到的现象是否相同不同.
分析 ①铜与浓硫酸加热直接反应,生成二氧化硫,会污染环境,二氧化硫具有漂白性,使品红褪色,且二氧化硫为酸性氧化物;
②由Cu→CuO→CuSO4,不生成有害气体,且消耗酸少,以此来解答.
(1)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应过程中生成污染性气体,方案②无污染性气体生成,原料消耗少;
(2)二氧化硫具有漂白性,可观察到品红褪色,若通入盛有石蕊试液的试管中,看到的现象是溶液变色红色,氯气和水反应生成的次氯酸具有漂白性,可以使品红溶液褪色,通入石蕊试液先变红色后褪色;
解答 解:(1)因①生成有害气体,②中不生成有害气体,且消耗酸少,故答案为:②;无污染物产生,节约原料;
(2)方案①铜与浓硫酸加热直接反应制取硫酸铜时,会有气体二氧化硫产生,若将产生的气体通入盛有品红溶液的试管中,二氧化硫具有漂白性,可观察到品红褪色,若将Cl2通入品红溶液中也能看到同样的现象,如果不从气体颜色上去判断,可以通过漂白性的可逆性分析设计,对褪色的溶液加热,若恢复红色则是二氧化硫的漂白性,若加热不能恢复溶液颜色,证明为氯气导致的品红溶液褪色,若二氧化硫通入盛有石蕊试液的试管中,看到的现象是溶液变色红色,氯气和水反应生成的次氯酸具有漂白性,可以使品红溶液褪色,若石蕊试液中通入氯气,通入石蕊试液先变红色后褪色,二氧化硫和氯气(Cl2)分别通入盛有石蕊试液的试管中,看到的现象不相同,
故答案为:品红溶液褪色,对褪色的溶液加热,若恢复红色则是二氧化硫的漂白性,若加热不能恢复溶液颜色,证明为氯气导致的品红溶液褪色;不同.
点评 本题考查化学实验方案的评价,为高频考点,侧重二氧化硫的性质及硫酸铜制备的考查,注意二氧化硫的漂白性只使品红溶液褪色,题目难度中等.

练习册系列答案
相关题目
2.已知氟化氢气体中有平衡关系:
2H3F3(g)?3H2F2(g)△H1=a kJ•mol-1
H2F2 (g)?2HF (g)△H2=b kJ•mol-1
已知a、b均大于0;则可推测反应:H3F3(g)?3HF(g)的△H3为( )
2H3F3(g)?3H2F2(g)△H1=a kJ•mol-1
H2F2 (g)?2HF (g)△H2=b kJ•mol-1
已知a、b均大于0;则可推测反应:H3F3(g)?3HF(g)的△H3为( )
| A. | +(a+b)kJ•mol-1 | B. | +(a-b)kJ•mol-1 | ||
| C. | +(a+3b)kJ•mol-1 | D. | +(0.5a+1.5b)kJ•mol-1 |
20. 向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )
向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )
 向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )
向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )| A. | 硝酸钙与硫酸钾的混合液 | B. | 氯化钡与碳酸钠的混合液 | ||
| C. | 硫酸镁与氢氧化钾的混合液 | D. | 氯化铝与硝酸钠的混合液 |
13.某同学拟用粗氧化铜(含少量FeO及不溶于酸的杂质)制取无水氯化铜,流程如图所示:
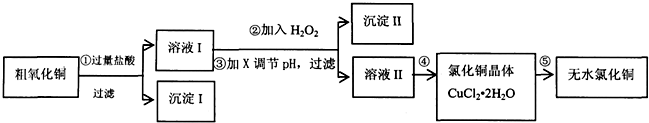
(1)步骤①中氧化铜与盐酸反应的离子方程式:CuO+2H+=Cu2++H2O.
(2)步骤②中加入H2O2的目的:将Fe2+氧化成Fe3+,沉淀Ⅱ的化学式为:Fe(OH)3.
(3)已知:
步骤③中调节溶液pH的试剂X可以是BC(双选,填编号).
A.NaOH B.CuO C.Cu(OH)2 D.NH3•H2O
(4)步骤④的操作是蒸发浓缩、冷却结晶,过滤、洗涤、干燥.为得到无水CuCl2,步骤⑤需在干燥的HCl气流中加热CuCl2•2H2O,原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.

(1)步骤①中氧化铜与盐酸反应的离子方程式:CuO+2H+=Cu2++H2O.
(2)步骤②中加入H2O2的目的:将Fe2+氧化成Fe3+,沉淀Ⅱ的化学式为:Fe(OH)3.
(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
A.NaOH B.CuO C.Cu(OH)2 D.NH3•H2O
(4)步骤④的操作是蒸发浓缩、冷却结晶,过滤、洗涤、干燥.为得到无水CuCl2,步骤⑤需在干燥的HCl气流中加热CuCl2•2H2O,原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.
 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应: