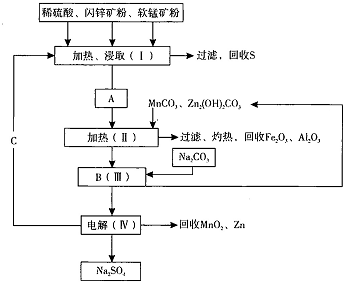
题目内容
10.把铝、铁混合物1.1g溶于过量200mL5mol/L盐酸中,反应后盐酸浓度变为4.6mol/L(溶液体积变化忽略不计).求:(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
(3)产生氢气的体积(标准状况).
分析 发生反应为Fe+2H+=Fe2++H2↑、2Al+6H+=2Al3++3H2↑,
(1)计算盐酸浓度的变化,再根据n=cV计算消耗HCl的物质的量;
(2)设Al、Fe的物质的量分别为x、y,根据二者质量之和、电子转移守恒列方程计算解答;
(3)根据H原子守恒计算生成氢气的物质的量,再根据V=nVm计算氢气的体积.
解答 解:(1)盐酸的浓度变化为:5mol/L-4.6mol/L=0.4mol/L,
消耗HCl的物质的量为:n(HCl)=0.2L×0.4mol/L=0.08mol,
答:反应中消耗HCl的物质的量为0.08mol;
(2)设Al、Fe的物质的量分别为x、y,根据二者质量、电子转移守恒有:27x+56y=1.1、3x+2y=0.08,
解得:x=0.02mol、y=0.01mol,
答:该混合物中铝、铁的物质的量分别为0.02mol、0.01mol;
(3)根据氢原子守恒可知n(H2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.08mol=0.04mol,
则生成标准状况下氢气的体积为:V(H2)=0.04mol×22.4L/mol=0.896L,
答:产生的标准状况下气体的体积为0.896.
点评 本题考查混合物的有关计算,题目难度中等,明确发生反应的实质为解答关键,可以利用关系式计算氢气的物质的量,试题培养了学生的化学计算能力.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
1. 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应 和实验装置如图:
和实验装置如图:
可能用到的有关数据如下:
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯11.48g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).A.立即补加B.冷却后补加C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为 .
.
(4)分液漏斗在使用前检漏并须清洗干净;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有ACD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是70%.
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应 和实验装置如图:
和实验装置如图:可能用到的有关数据如下:
| 相对分子质量 | 密度/(g?cm-3 ) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯11.48g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).A.立即补加B.冷却后补加C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前检漏并须清洗干净;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有ACD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是70%.
15.影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.
实验药品:铜,铁,镁,0.5mol/L H2SO4,2mol/L H2SO4,18.4mol/L H2SO4
Ⅰ.甲同学研究的实验报告如表:
实验步骤现象结论①分别取等体积的2mol/L的硫酸于试管中②反应速率:镁>铁,铜不反应金属的性质越活泼,反应速率越快
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Mg.
(2)甲同学的实验目的是探究反应物本身的性质对反应速率的影响;要得出正确的实验结论,还需控制的实验条件是温度相同.
Ⅱ.乙同学为了更精确的研究浓度对反应速率的影响,利用右图所示装置进行实验,
(3)乙同学在实验中应该测定的数据是一定时间内产生气体的体积(或产生一定体积的气体所需的时间).
(4)乙同学完成该实验应选用的实验药品镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4.
(5)图中仪器A的名称是分液漏斗,检验该装置气密性的方法是按住注射器活塞不动,向分液漏斗中倒水,液面高度不变,说明装置气密性良好.

实验药品:铜,铁,镁,0.5mol/L H2SO4,2mol/L H2SO4,18.4mol/L H2SO4
Ⅰ.甲同学研究的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的 2 mol/L的硫酸于试管 | 反应速率:镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Mg.
(2)甲同学的实验目的是探究反应物本身的性质对反应速率的影响;要得出正确的实验结论,还需控制的实验条件是温度相同.
Ⅱ.乙同学为了更精确的研究浓度对反应速率的影响,利用右图所示装置进行实验,
(3)乙同学在实验中应该测定的数据是一定时间内产生气体的体积(或产生一定体积的气体所需的时间).
(4)乙同学完成该实验应选用的实验药品镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4.
(5)图中仪器A的名称是分液漏斗,检验该装置气密性的方法是按住注射器活塞不动,向分液漏斗中倒水,液面高度不变,说明装置气密性良好.
2.下列实验事实可以用同一反应原理解释的是( )
| A. | 活性炭、氯气都能使品红溶液褪色 | |
| B. | 苯、乙醇、纤维素都能与浓硝酸反应 | |
| C. | 乙烯、氯乙烯都能使溴水褪色 | |
| D. | 淀粉、蛋白质都能发生显色(或颜色)反应 |
19.下列说法中正确的是( )
| A. | 在标准状况下,1 mol水的体积约为22.4L | |
| B. | 只有在标准状况下,气体的摩尔体积才是22.4mol/L | |
| C. | 在标准状况下,1molH2和O2的混合气体体积约为22.4 L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L/mol |
20.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式: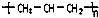 | B. | 乙醇的结构式:CH3CH2OH | ||
| C. | 四氯化碳分子的电子式为: | D. | 丙烷分子的球棍模型为: |