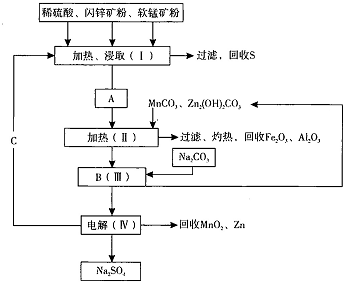
题目内容
15.指出下列各物质中划线元素的化合价:N2O NaH H2O2 KO2 KClO4 NaS2O3 K2MnO4 K2Cr2O7 Mn2O7 Fe3O4.
分析 根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,结合各化学式进行解答本题.
解答 解:N2O 中氧为-2价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得2x-2=0,解得x=+1价;
NaH中钠为+1价,设氢元素的化合价是x,根据在化合物中正负化合价代数和为零,可得,+1+x=0,解得x=-1价;
H2O2中氢为+1价,设氧元素的化合价是x,根据在化合物中正负化合价代数和为零,可得2×1+2x=0,解得x=-1价;
KO2中钾为+1价,设氧元素的化合价是x,根据在化合物中正负化合价代数和为零,可得2x+1=0,解得x=-$\frac{1}{2}$价;
KClO4 钾元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零:(+1)+x+(-2)×4=0,解得y=+7;
NaS2O3 钠元素显+1价,氧元素显-2价,设硫元素的化合价是x,根据在化合物中正负化合价代数和为零:(+1)+2x+(-2)×3=0,解得x=+$\frac{5}{2}$;
K2MnO4 钾元素显+1价,氧元素显-2价,设锰元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,解得x=+6;
K2Cr2O7钾元素显+1价,氧元素显-2价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x+(-2)×7=0,解得x=+6;
Mn2O7氧元素显-2价,设锰元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:2x+(-2)×7=0,解得x=+2价;
Fe3O4氧元素显-2价,设铁元素化合价为x,根据在化合物中正负化合价代数和为零,可得:3x+(-2)×4=0,解得x=+$\frac{8}{3}$价;
故答案为:+1;-1;-1;+$\frac{1}{2}$;+7;+$\frac{5}{2}$;+6;+7;+$\frac{8}{3}$;
点评 本题考查元素化合价判断,难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答.

| A. | 漂白粉可长期放置在烧杯中 | |
| B. | 金属钠燃烧时不能用水灭火,应该用沙子灭火 | |
| C. | 氯水可以用无色透明的试剂瓶装保存 | |
| D. | 实验后剩余的钠不可放回原试剂瓶中 |
 向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )
向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )| A. | 硝酸钙与硫酸钾的混合液 | B. | 氯化钡与碳酸钠的混合液 | ||
| C. | 硫酸镁与氢氧化钾的混合液 | D. | 氯化铝与硝酸钠的混合液 |
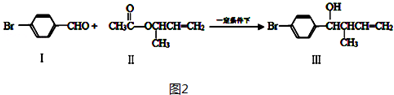
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应 和实验装置如图:
和实验装置如图:可能用到的有关数据如下:
| 相对分子质量 | 密度/(g?cm-3 ) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯11.48g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).A.立即补加B.冷却后补加C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前检漏并须清洗干净;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有ACD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是70%.

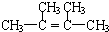
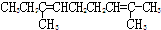 .
.