题目内容
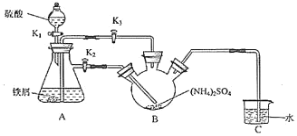
【题目】废钯催化剂中含钯 5-6%,碳 93-94%,铁 1-2%,铜 0.1-0.2%以及锌等杂质。在实验室中探究采用废钯催化剂制备无水氯化钯,具体流程如下:
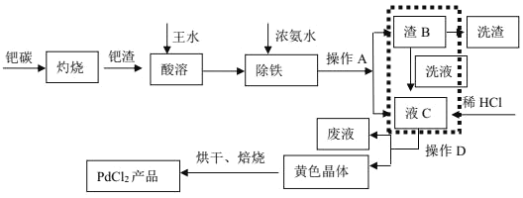
已知:Pd2+、Cu2+、Zn2+等离子均可与氨水生成[M(NH3)n]x+离子,其中[Pd(NH3)2]2+在盐酸中能以[Pd(NH3)2]Cl2 黄色晶体的形式析出。
(1)灼烧钯碳时使用的主要仪器有:酒精灯、玻璃棒、_____(支持仪器省略)。王水溶解过程中会生成 NOCl,NOCl 的结构式为________。
(2)是否进行虚线方框内的操作,对提高钯的回收率至关重要,其主要原因是_____。
(3)最后焙烧之前若不烘干,所得产品中会混有_____杂质。
(4)可用“化学放大”法测定样品中的微量 Fe3+:在酸性介质中加入过量的 KI 后用CCl4萃取,分去水相后,用肼(N2H4)的水溶液进行还原并反萃取,还原过程中有无污染的气体生成。再用过量的 Br- 将反萃取出的 I- 氧化成 IO3- ,煮沸除 Br2后,加入过量的 KI,酸化后用Na2S2O3 标准液进行滴定。经上述步骤后,样品含量的测定值放大了_____倍,写出还原过程中发生反应的离子方程式___________,假定萃取达到平衡时,样品在水和萃取剂中的总浓度比为 1∶80,50mL 的水溶液样品,用 10mL 萃取剂萃取,萃取后溶液中残留的样品浓度为原溶液的_______________倍(用分数表示)。完成萃取和反萃取操作,必须选用的仪器有____________(填标号)。

【答案】坩埚 O=N-Cl Fe(OH)3 为胶状沉淀,对[Pd(NH3)2]2+具有很强的吸附作用,若不进行此操作, [Pd(NH3)2]2+的吸附损失大 PdO 6 N2H4+2I2=4I-+N2↑+4H+ 1/17 B
【解析】
废钯催化剂经烘干后,在700℃的高温下焙烧,C、Fe、Pd、有机物被氧气氧化生成氧化物,向氧化物中加入王水,滤渣中含有Pd、SiO2,二氧化硅不溶于王水,但Pd能溶于王水生成溶液,同时生成气体,加入浓氨水调节溶液pH,钯转变为可溶性[Pd(NH3)2]2+,使铁全部沉淀,溶液中加入盐酸酸析得到沉淀,经过脱氨等一系列操作得当氯化钯。
(1)灼烧固体要在坩埚中进行,灼烧钯碳时使用的主要仪器有:酒精灯、玻璃棒、坩埚。由于NOCl中所有原子都达到了8电子稳定结构,即N形成3对共价键,O形成2对共价键,Cl形成1对共价键,即电子式为:![]() ,其结构式为O=N-Cl,
,其结构式为O=N-Cl,
故答案为:坩埚;O=N-Cl;
(2)虚线方框内的操作主要是除去Fe(OH)3,[Pd(NH3)2]2+在盐酸中能以[Pd(NH3)2]Cl2 黄色晶体的形式析出,是否进行虚线方框内的操作,对提高钯的回收率至关重要,其主要原因是Fe(OH)3 为胶状沉淀,对[Pd(NH3)2]2+具有很强的吸附作用,若不进行此操作, [Pd(NH3)2]2+的吸附损失大。
故答案为:Fe(OH)3 为胶状沉淀,对[Pd(NH3)2]2+具有很强的吸附作用,若不进行此操作, [Pd(NH3)2]2+的吸附损失大;
(3)脱氨将Pd(NH3)2Cl2变化为PdCl2,发生反应的化学方程式为Pd(NH3)2Cl2═PdCl2+2NH3↑,最后焙烧之前若不烘干,PdCl2水解生成Pd(OH)2,受热分解,所得产品中会混有 PdO杂质。
故答案为: PdO;
(4)可用“化学放大”法测定样品中的微量 Fe3+:在酸性介质中加入过量的 KI 发生的反应为:2Fe3++2I-=2Fe2++I2,后用CCl4萃取,分去水相后,用肼(N2H4)的水溶液进行还原并反萃取,还原过程中有无污染的气体生成,反应为N2H4+2I2=4I-+N2+4H+。再用过量的 Br2 将反萃取出的 I- 氧化成 IO3- ,煮沸除 Br2后,加入过量的 KI,发生反应:5I-+IO3-+6H+=3I2+3H2O;酸化后用Na2S2O3 标准液进行滴定,发生反应:2Na2S2O3+I2=Na2S4O6+2NaI。经上述步骤后,有以下关系式:2Fe3+~I2~2I-~2IO3-~6I2,样品含量的测定值放大了6倍,还原过程中发生反应的离子方程式 N2H4+2I2=4I-+N2↑+4H+ ,假定萃取达到平衡时,样品在水和萃取剂中的总浓度比为 1∶80,50mL 的水溶液样品,设浓度为c,用 10mL 萃取剂萃取,萃取后溶液中残留的样品浓度为b,萃取剂中的浓度为![]() ,则有
,则有 ,
,![]() 萃取后溶液中残留的样品浓度为原溶液的
萃取后溶液中残留的样品浓度为原溶液的![]() 倍(用分数表示)。完成萃取和反萃取操作,在分液漏斗中进行,必须选用的仪器有B(填标号)。
倍(用分数表示)。完成萃取和反萃取操作,在分液漏斗中进行,必须选用的仪器有B(填标号)。
故答案为: 6 ; N2H4+2I2=4I-+N2↑+4H+ ;![]() ; B。
; B。

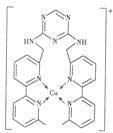
【题目】某分子的结构如图所示(-R 为烃基),其中 A、B、D 三种元素位于元素周期表中同一族的三个相邻的周期,A 的非金属性大于 B。D 与 G 形成的 DG3 在工业上可用于漂白和杀菌消毒。A 与 G 形成的 AG3 可完全水解,其水解的产物之一 H3AO3 常用作塑料件镀金属的还原剂。

(1)具有未成对电子的原子或分子具有磁性。D 的某种氧化物 D2O4 的磁性大小与温度呈正相关关系,即磁性是温度的增函数。则 D2O4 ![]() 2DO2,ΔH______0(填“>”“<”或“=”)。
2DO2,ΔH______0(填“>”“<”或“=”)。
(2)DG3 用于杀菌消毒与 HGO 相比,DG3 可大大延长杀菌消毒的时间,试从反应速率理论和平衡移动理论两者中选择一个,解释其原因____________________________。
(3)无机含氧酸中的非羟基氢不能发生电离。H3AO3 分子中 A 原子最外层的电子都参与了共价键的形成,试用方程式表示 H3AO3 的正盐溶液呈碱性的原因_____。
(4)液氨中因存在2NH3(1) ![]() NH4++NH2-可导电,液态 D2O4 中也存在 D2O4
NH4++NH2-可导电,液态 D2O4 中也存在 D2O4![]() DO++DO3-,上述两个过程的本质区别为___________。
DO++DO3-,上述两个过程的本质区别为___________。
(5)T℃时,在一体积为 VL 的密闭容器中放入一定量的 ACl5 固体,按下式发生反应:ACl5(s)![]() ACl3(g)+Cl2(g),ΔH>0。测得容器内气体的压强变化如下表:
ACl3(g)+Cl2(g),ΔH>0。测得容器内气体的压强变化如下表:
时间 t/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 | ∞ |
总压 P/kPa | 0 | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 | 5.0 | 5.0 |
上述条件下,以分压表示的平衡常数 Kp=_____(kPa)2(计算结果保留两位小数); 若保持温度不变,30s 时给容器加压,达新平衡后,容器内的总压将_____(填“升高”、“降低”或“不变”);若将容器换成绝热容器,加压后容器内的总压将_____(填“升高”、“降低”或“不变”)。
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如图:

回答下列问题:
(1)滤液中的阴离子为_____。
(2)“酸浸”所使用的酸为_____。
(3)“净化除杂”是为了除铁,需加入H2O2溶液,溶液变成棕黄色,发生反应的离子方程式为__;一段时间后。溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是__;然后调节pH就可使溶液中铁元素完全沉淀,若使其刚好沉淀完全(离子浓度为1.0×10-5mol/L),此时的pH=__(保留一位小数)
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)关于铁铝化合物的下列说法正确的是__(填序号)。
①配制FeCl3、AlCl3溶液时,均是先将固体FeCl3、AlCl3溶于较浓的盐酸,再用蒸馏水稀释到所需浓度
②FeCl2、FeCl3、Fe(OH)3均可以通过化合反应生成
③利用氯水和KSCN溶液可以检验FeCl3溶液中有无Fe2+
④加热蒸干Al2(SO4)3溶液残留固体的成分为Al2O3