题目内容
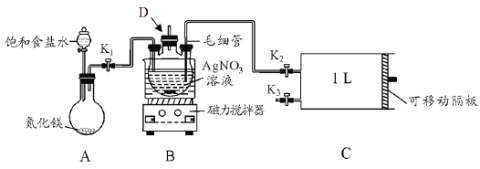
【题目】某学习小组根据高中知识设计如下测定室内甲醛含量的装置(夹持装置已略)。
I.配制银氨溶液
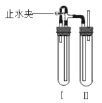
⑴盛装AgNO3溶液的仪器D的名称_____________。
⑵关闭K2和K3,打开K1和分液漏斗活塞,将饱和食盐水滴入到圆底烧瓶中,当观察到D中最初生成的白色沉淀恰好完全溶解时,关闭K1和分液漏斗活塞。请写出A装置中发生反应的化学方程式_________;饱和食盐水的用途是________。
Ⅱ.测定室内空气中甲醛含量
⑶用热水浴加热D,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是_______________。
⑷装置中毛细管的作用是________________。
⑸已知甲醛被银氨溶液氧化的化学方程式为:HCHO+4Ag(NH3)2OH=(NH4)2CO3+4Ag↓+6NH3↑+2H2O,测得共生成Ag 2.16mg。则空气中甲醛的含量为_______mg.L-1(空气中其它物质不与银氨溶液反应)。
⑹该设计装置存在一个明显的不足之处是____________。
【答案】三颈烧瓶 Mg3N2+6H2O=3Mg(OH)2+2NH3↑ 减缓反应速率 打开K1,缓慢推动滑动隔板,将气体全部推出,再关闭K2 减少气体通入速率,使空气中甲醛气体被完全吸收 0.15 缺少尾气处理装置
【解析】
氮化镁和饱和食盐水反应生成氨气和氢氧化镁,氨气缓缓通入到硝酸银溶液中,先生成沉淀后沉淀溶解,停止通入氨气,吸入1L空气后缓缓压入到银氨溶液中,使甲醛与银氨溶液充分反应,根据生成的银的质量计算甲醛的物质的量,计算空气中甲醛的含量。
I⑴根据图中信息得知盛装AgNO3溶液的仪器D的名称三颈烧瓶;故答案为:三颈烧瓶。
⑵A装置中是氮化镁和水反应生成氢氧化镁和氨气,发生反应的化学方程式Mg3N2+6H2O =3Mg(OH)2+2NH3↑;饱和食盐水是降低水的浓度,其用途是减缓反应速率;故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;减缓反应速率。
Ⅱ⑶用热水浴加热D,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,主要是将空气中甲醛与银氨溶液反应,因此后续操作是打开K1,缓慢推动滑动隔板,将气体全部推出,再关闭K2;故答案为:打开K1,缓慢推动滑动隔板,将气体全部推出,再关闭K2。
⑷为了缓缓的通入空气到银氨溶液中,使空气中甲醛气体被完全吸收,因此装置中使用毛细管;故答案为:减少气体通入速率,使空气中甲醛气体被完全吸收。
⑸根据HCHO ~4Ag↓,测得共生成Ag 2.16mg即物质的量为2×105 mol,因此n(HCHO)=5×106 mol,则空气中甲醛的含量为![]() ;故答案为:0.15。
;故答案为:0.15。
⑹由于反应生成了氨气,氨气会污染环境,因此该设计装置存在一个明显的不足之处是缺少尾气处理装置;故答案为:缺少尾气处理装置。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成一种熔合物,根据下列四种金属的熔沸点,其中不能形成合金的是
Na | Cu | Al | Fe | |
熔点/ | 97.5 | 1083 | 660 | 1535 |
沸点/ | 883 | 2595 | 2200 | 3000 |
A.Cu和AlB.Fe和CuC.Fe和NaD.A1和Na