题目内容
【题目】铝是一种重要金属:
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:___
(2)铝与NaOH溶液反应的离子方程式为:___。
(3)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
①I和II步骤中分离溶液和沉淀的操作是;___;
②沉淀M中除含有泥沙外,一定还含有___,固体N是___;
③滤液X中,含铝元素的溶质的化学式为___,它属于___(填“酸”、“碱”或“盐”)类物质;
④实验室里常往AlCl3溶液中加入___(填“氨水”或“NaOH溶液”)来制取A1(OH)3。其反应的离子方程式为:___。
【答案】2Al+Fe2O3![]() Al2O3+2Fe 2Al+2OH﹣+2H2O=2AlO2+3H2↑ 过滤 Fe2O3 Al2O3 NaAlO2 盐 氨水 Al3++3NH3H2O═Al(OH)3↓+3NH4+
Al2O3+2Fe 2Al+2OH﹣+2H2O=2AlO2+3H2↑ 过滤 Fe2O3 Al2O3 NaAlO2 盐 氨水 Al3++3NH3H2O═Al(OH)3↓+3NH4+
【解析】
由流程图可知,铝土矿中氧化铝和二氧化硅与氢氧化钠溶液反应生成偏铝酸钠和硅酸钠,氧化铁不与氢氧化钠溶液反应,则过滤后得到的沉淀M为氧化铁,滤液X为偏铝酸钠和硅酸钠混合液;向混合液中通入二氧化碳,并控制溶液pH,偏铝酸钠与二氧化碳反应生成碳酸钠和氢氧化铝沉淀,则过滤后得到滤液Y为碳酸钠和硅酸钠混合液;洗净后的氢氧化铝加热分解生成氧化铝。
(1)铝与氧化铁在高温下发生铝热反应生成铁盒氧化铝,反应的化学方程式为:2Al+Fe2O3![]() Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3![]() Al2O3+2Fe;
Al2O3+2Fe;
(2)金属铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的的离子方程式是:2Al+2OH﹣+2H2O=2AlO2+3H2↑,故答案为:2Al+2OH﹣+2H2O=2AlO2+3H2↑;
(3)①I和II步骤为分离溶液和沉淀的操作,该操作的名称为过滤,故答案为:过滤;
②沉淀M除含有泥沙外,主要是Fe2O3,氢氧化铝受热易分解生成氧化铝和水,所以固体N是Al2O3,故答案为:Fe2O3;Al2O3;
③滤液X中,含铝元素的溶质是偏铝酸钠,化学式为NaAlO2,属于盐类,故答案为:NaAlO2;盐;
④实验室里常往AlCl3溶液中加入氨水可以制取氢氧化铝,氢氧化铝不溶于弱碱,反应原理为:Al3++3NH3H2O═Al(OH)3↓+3NH4+,故答案为:氨水;Al3++3NH3H2O═Al(OH)3↓+3NH4+。

【题目】下列实验的现象与结论相对应的是( )
A | B | C | D | |
实验 |
|
|
|
|
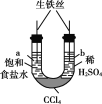
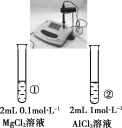
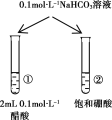
现象 | 一段时间后,a管液面高于b管液面 | 酸性KMnO4溶液褪色 | pH计测得①中pH大于②中pH | 试管①中有大量气泡,试管②中无现象 |
结论 | a管发生吸氧腐蚀,b管发生析氢腐蚀 | 有乙烯生成可以使酸性KMnO4溶液褪色 | 金属性:Mg>Al | 酸性:醋酸>碳酸>硼酸 |
A.AB.BC.CD.D