题目内容
【题目】用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入__。
(2)除去蒸馏水中溶解的O2常采用___的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是__。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
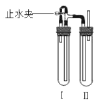
(1)在试管I里加入的试剂是___。
(2)在试管II里加入的试剂是___。
(3)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后的实验步骤是:先___,后__。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是__。
【答案】稀硫酸、铁屑 煮沸 避免生成的Fe(OH)2与O2接触 稀H2SO4、铁屑 NaOH溶液 检验试管II出口处排出的氢气的纯度 夹紧止水夹 试管I中反应生成的H2充满了试管I和试管II,且外界空气不容易进入
【解析】
方法一:(1)根据FeSO4易被空气中的氧气氧化和易水解的特点回答;
(2)根据气体的溶解度随温度的升高而减小回答;
(3)根据氢氧化亚铁极易被空气中的氧气氧化成氢氧化铁回答;
方法二:(1)根据实验的基本原理回答,该方法的原理是利用稀H2SO4和铁屑产生氢气,先赶净装置中空气,防止空气中的氧气把二价铁氧化为三价铁.确定赶净空气后再夹紧止水夹,通过H2产生的压强将FeSO4压入NaOH溶液中去,从而产生的白色Fe(OH)2沉淀;
(2)分析同(1);
(3)根据生成的氢气使装置中的气压变大,才能把反应生成的硫酸亚铁压入氢氧化钠溶液中回答;
(4)根据氢气有还原性,可防止空气进入装置把氢氧化亚铁氧化回答。
方法一:(1)根据FeSO4具有易被氧化和易水解的特点,在配制其溶液时还需加入稀H2SO4防止 发生水解反应,同时加入铁屑防止硫酸亚铁被氧化;
(2)蒸馏水中若溶有O2,则会加速Fe(OH)2氧化,由于氧气的溶解度随温度的升高而减小,因此可采用加热煮沸的方法除去;
(3)为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的;
方法二:该方法的原理是利用稀H2SO4和铁屑产生氢气,先赶净装置中空气,防止空气中的氧气把二价铁氧化为三价铁.确定赶净空气后再夹紧止水夹,通过H2产生的压强将FeSO4压入NaOH溶液中去,从而使产生的白色Fe(OH)2沉淀在H2的还原性气氛中得以较长时间保持.所以:
(1)在试管Ⅰ里加入的试剂是稀H2SO4和铁屑,目的是通过二者反应生成氢气,同时产生硫酸亚铁;
(2)在试管Ⅱ里加入的试剂是NaOH溶液,目的是让它与试管Ⅰ中生成的硫酸亚铁反应,生成氢氧化亚铁沉淀;
(3)在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是:先检验试管Ⅱ出口处排出的氢气的纯度,防止装置中仍有空气.当排出的H2纯净时,再夹紧止水夹,以便产生高压,把硫酸亚铁溶液压入氢氧化钠溶液中;
(4)由于装置中始终充满氢气,外界空气不容易进入,所以Fe(OH)2沉淀能较长时间保持白色。

 阅读快车系列答案
阅读快车系列答案【题目】2019年国际非政府组织“全球计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋缓。CO2的综合利用是解决温室问题的有效途径。
(1)CO2催化加氢制甲醇的有关反应及其在不同温度下的化学平衡常数如下表所示。
化学反应 | 平衡常数 | ||
500℃ | 700℃ | 800℃ | |
Ⅰ.H2(g)+CO2(g) H2O(g)+CO(g) | 1.0 | 1.70 | 2.52 |
Ⅱ.2H2(g)+CO(g) CH3OH(g) | 2.5 | 0.34 | 0.15 |
Ⅲ.3H2(g)+CO2(g) CH3OH(g)+H2O(g) ΔH | |||
①ΔH___0(填“>”、“<”或“=”)。
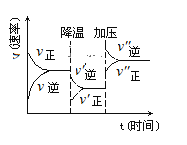
②已知反应Ⅲ的速率方程式:υ正=k正·c3(H2)·c(CO2),υ逆=k逆·c(CH3OH)·c(H2O),k正、k逆为速率常数。反应达到平衡后,仅升高温度,k正增大的倍数___k逆增大的倍数(填“大于”、“小于”或“等于”)。
③500℃时,向恒容的密闭容器中加入1molCO2和1molH2,控制反应条件只发生反应Ⅰ。达到平衡后,只改变下列条件,能使CO的平衡体积分数增大的是___(填选项字母)。
A.增大压强 B.降低温度 C.再通入等物质的量CO2和H2 D.分离出部分水
(2)在200℃时,向5L带气压计的恒容密闭容器中通入2molCO2和2molCH4发生反应CH4(g)+CO2(g)2H2(g)+2CO(g),测得初始压强为P0kPa,反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示。
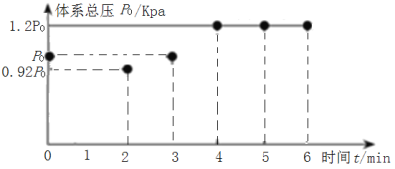
①该反应过程中从0min到2min压强变化原因是___。
②0~4min内,反应的平均反应速率υ(CO2)=___。
③用平衡分压代替平衡浓度表示的化学平衡常数Kp=___。[气体分压(p分)=气体总压(p总)×气体体积分数]
(3)科学家提出利用CO2与CH4制备“合成气”(CO、H2)可能的反应历程如图所示。
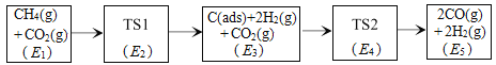
注:C(ads)为吸附性活性炭,方框内包含微粒种类及数目、微粒的相对总能量[如第一个方框中1个CH4(g)+1个CO2(g)的相对总能量为E1eV,单位:eV]。其中,TS表示过渡态。
①CH4(g)+CO2(g) 2H2(g)+2CO(g)ΔH=___kJ·mol-1(已知:1eV=1.6×10-22kJ)
②若E4+E1<E3+E2,则决定制备“合成气”反应速率的反应方程式为___。