题目内容
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是____。若测定结果偏高,其原因可能是_____。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后未用待测液润洗
D.滴定管滴定前无气泡,滴定后有气泡
(2)判断滴定终点的现象是________。
(3)如图是某次滴定时的滴定管中的液面,其读数为_____mL。
![]()
(4)根据下列数据,请计算待测盐酸的浓度:_________mol·L-1。
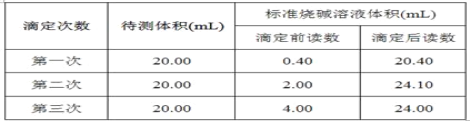
【答案】① AB 滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红色,且半分钟内不褪色 22.60 0.200 0
【解析】
(1)根据碱式滴定管在装液前应用所装液体进行润洗,用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上,碱式滴定管未用标准盐酸溶液润洗就直接注入标准NaOH溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=![]() ,可知c(标准)偏大,
,可知c(标准)偏大,
A.配制标准溶液的固体NaOH中混有KOH杂质,标准溶液中氢氧根离子的浓度偏小,消耗的V(标准)增大,c(待测)=![]() 分析,测定结果偏高,故A正确;
分析,测定结果偏高,故A正确;
B.滴定终点读数时,仰视滴定管的刻度,读取消耗的V(标准)偏大,c(待测)=![]() 分析,测定结果偏高,故B正确;
分析,测定结果偏高,故B正确;
C.盛装待测液的锥形瓶用蒸馏水洗过后未用待测液润洗,对滴定的数据结果无影响,故C错误;
D.所配的标准NaOH溶液物质的量浓度偏大,滴定过程中溶液变红色早,消耗的V(标准)偏小,c(待测)=![]() 分析,测定结果偏低,故D错误;
分析,测定结果偏低,故D错误;
故答案为:①;AB;
(2)滴定终点时溶液颜色由无色突变为红色,且半分钟内不褪色,判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红色,且半分钟内不褪色;
故答案为:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红色,且半分钟内不褪色;
(3)依据滴定管构造及精确度可知图中液面读数为:22.60;
故答案为:22.60;
(4)三次消耗标准液体积分别为:20.00,20.00,22.10,第三组数据误差较大,应舍弃,则消耗标准液平均体积为:20.00mL,待测液浓度为:![]() =0.2000mol/L;
=0.2000mol/L;
故答案为:0.2000。

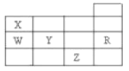
【题目】下列实验的现象与结论相对应的是( )
A | B | C | D | |
实验 |
|
|
|
|
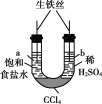
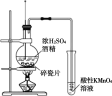
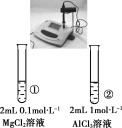
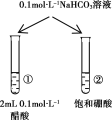
现象 | 一段时间后,a管液面高于b管液面 | 酸性KMnO4溶液褪色 | pH计测得①中pH大于②中pH | 试管①中有大量气泡,试管②中无现象 |
结论 | a管发生吸氧腐蚀,b管发生析氢腐蚀 | 有乙烯生成可以使酸性KMnO4溶液褪色 | 金属性:Mg>Al | 酸性:醋酸>碳酸>硼酸 |
A.AB.BC.CD.D