题目内容
在容积一定的密闭容器中,进行可逆反应N2(g)+3H2(g) 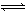 2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是
2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是
| A.T2<T1 |
| B.P2>P1 |
| C.若P3<P4,y轴表示N2的转化率 |
| D.若P3>P4,y轴表示NH3的体积分数 |
C
解析试题分析:A、根据图1可知,在压强均为P2的条件下,温度为T1的曲线首先达到平衡状态,这说明温度为T1时反应速率快,达到平衡的时间少。温度高反应速率快,所以温度是T2<T1,A正确;B、碳氧根据图1可知,在温度均T1的条件下,压强为P2的首先达到平衡状态,这说明压强为P2时反应速率快,达到平衡的时间少。压强大反应速率快,所以压强是P2>P1,B正确;C、该反应是体积减小的可逆反应,增大压强反应物的转化率增大。若P3<P4,则压强为P4时的转化率大于压强P3时的转化率,C不正确;D、增大压强平衡向正反应方向移动,氨气的体积分数增大,所以若P3>P4,y轴可以表示NH3的体积分数,D正确,答案选C。
考点:考查外界条件对反应速率和平衡状态的影响以及图像识别

温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80%
工业上可利用合成气(CO和H2的混合气体)生产甲醇。已知:
CO(g)+2H2(g) CH3OH(g) ΔH=—92.9kJ/mo1
CH3OH(g) ΔH=—92.9kJ/mo1
一定条件下,该反应在一体积固定的密闭容器中达到平衡。下列说法正确的是
| A.该反应的△S<0 |
| B.该反应在任何温度下均能自发进行 |
| C.向容器中充入少量He,平衡向正反应方向移动 |
| D.升高温度平衡向正反应方向移动 |
汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:
2NO(g)+2CO(g) N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4 mol·L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3 mol·L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
经分析,得出结论不正确的是
A.2~3 s间的平均反应速率v(NO)=9×10-5 mol/(L·s)
B.催化转化器对废气的转化速率在夏季时比冬季时高
C.若该催化转化器气舱容积为2 L,则达到平衡时反应放出热量1.8a J
D.该温度下,此反应的平衡常数K=5000
NO2存在下列平衡:2NO2(g)  N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
| A.温度130℃、压强3.03×105 Pa | B.温度25℃、压强1.01×105 Pa |
| C.温度130℃、压强5.05×104 Pa | D.温度0℃、压强5.05×104 Pa |
某恒温密闭容器发生可逆反应

 ,在
,在 时刻反应达到平衡,在
时刻反应达到平衡,在 时刻缩小容器体积,
时刻缩小容器体积,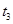 时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
| A.Z和W在该条件下至少有一个是为气态 |
B. 时间段与 时间段与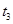 时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
C.若在该温度下此反应平衡常数表达式为K=c(X),则 时间段与 时间段与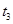 时刻后的X浓度不相等 时刻后的X浓度不相等 |
D.若该反应只在某温度 以上自发进行,则该反应的平衡常K随温度升高而增大 以上自发进行,则该反应的平衡常K随温度升高而增大 |
CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ( )
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ( )
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2NH3(g)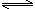 N2(g)+3H2(g) △H=+92.4kJ/mol
N2(g)+3H2(g) △H=+92.4kJ/mol
实验测的起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| NH3 | N2 | H2 | ||
| ① | 2 | 0 | 0 | 吸收热量akJ |
| ② | 0 | 1 | 3 | 放出热量bkJ |
| ③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是
A.热量关系:a=b
B.反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态




