题目内容
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80%
C
解析试题分析:A、根据表中数据可知,反应进行到50s时生成三氯化磷的物质的量是0.16mol,其浓度是0.16mol÷2L=0.08mol/L,所以反应在前50 s的平均速率为v(PCl3)=0.08mol/L÷50s=0.0016mol·L-1·s-1,A不正确;B、平衡时三氯化磷的物质的量浓度是0.20mol÷2L=0.10mol/L,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol·L-1,这说明升高温度平衡向正反应方向移动,则正方应是吸热反应,即反应的△H>0,B不正确;C、根据表中数据以及方程式可知,平衡时三氯化磷和氯气的浓度均是0.10mol/L,而五氯化磷的浓度则是0.5mol/L-0.10molL=0.40mol/L,所以该温度下平衡常数K=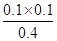 =0.025。相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,其浓度分别是0.5mol/L、0.1mol/L、0.1mol/L,则此时
=0.025。相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,其浓度分别是0.5mol/L、0.1mol/L、0.1mol/L,则此时 =0.02<0.025,这说明反应向正反应方向进行,因此达到平衡前v(正)>v(逆),C正确;D、相同温度下,起始时向容器中充入1.0molPCl3、1.0molCl2,则平衡是等效的,所以达到平衡时,PCl3的转化率为80%。但如果相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,则相当于是增大压强,平衡向生成五氯化磷的分析进行,因此达到平衡时,PCl3的转化率大于80%,D不正确,答案选C。
=0.02<0.025,这说明反应向正反应方向进行,因此达到平衡前v(正)>v(逆),C正确;D、相同温度下,起始时向容器中充入1.0molPCl3、1.0molCl2,则平衡是等效的,所以达到平衡时,PCl3的转化率为80%。但如果相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,则相当于是增大压强,平衡向生成五氯化磷的分析进行,因此达到平衡时,PCl3的转化率大于80%,D不正确,答案选C。
考点:考查可逆反应平衡常数、转化率以及反应速率的有关计算;外界条件对平衡状态的影响

 阅读快车系列答案
阅读快车系列答案难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下: TaS2(g)+ 2I2(g)TaI4(g) + S2(g),下列说法错误的是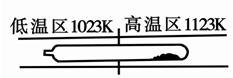
| A.在不同温度区域,TaI4 的量不同 |
| B.在提纯过程中,S2 的量不断增多 |
| C.该反应的平衡常数不随TaI4 和S2 的浓度增大而增大 |
| D.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区 |
对于可逆反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,降低温度产生的影响为
2SO3(g) ΔH<0,降低温度产生的影响为
| A.v正 增大,v逆减小 | B.v正减小,v逆增大 |
| C.v正和v逆同程度的减小 | D.v正和v逆不同等程度的减小 |
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2 2(t-BuNO)。在20℃时,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2 L)。下列说法正确的是
2(t-BuNO)。在20℃时,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2 L)。下列说法正确的是
| A.反应在前10 min内的平均速率为ν(t-BuNO)=0.0375mol·L-1·min-1 |
| B.保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)2的方向移动 |
| C.保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,则其能量关系可用右图表示 |
| D.保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率大于75% |
下列有关化学平衡移动叙述,正确的是( )
A.可逆反应:Cr2O742-+H2O 2CrO42-+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如上图一 2CrO42-+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如上图一 |
B.可逆反应Co(H2O) 62++ (粉红色)+4Cl- CoCl42-+ (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如上图二 CoCl42-+ (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如上图二 |
C.可逆反应:2NO2 N2O4达平衡状态呈红棕色,加压(缩小体积)红棕色变深,NO2物质的量随时间变化曲线如上图三 N2O4达平衡状态呈红棕色,加压(缩小体积)红棕色变深,NO2物质的量随时间变化曲线如上图三 |
D.可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如上图四 2NH3(g) ΔH<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如上图四 |
在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
| A.v(A2)=0.8 mol·L-1·s-1 | B.v(A2)=30 mol·L-1·min-1 |
| C.v(AB3)=1.0 mol·L-1·s-1 | D.v(B2)=1.2 mol·L-1·s-1 |
在温度相同,压强分别为p1、p2条件下,A(g)+2B(g) nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所示.下列结论正确的是
nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所示.下列结论正确的是
| A.p1 > p2 n < 3 | B.p1< p2 n > 3 |
| C.p1< p2n = 3 | D.p1 > p2n > 3 |
在容积一定的密闭容器中,进行可逆反应N2(g)+3H2(g) 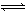 2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是
2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是
| A.T2<T1 |
| B.P2>P1 |
| C.若P3<P4,y轴表示N2的转化率 |
| D.若P3>P4,y轴表示NH3的体积分数 |
在1 100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)ΔH="a" kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
Fe(s)+CO2(g)ΔH="a" kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A.若生成1 mol Fe,则吸收的热量小于a kJ |
| B.若要提高CO的转化率,则应该加入适当的过量FeO |
| C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.026" 3 mol/L |