题目内容
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2NH3(g)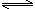 N2(g)+3H2(g) △H=+92.4kJ/mol
N2(g)+3H2(g) △H=+92.4kJ/mol
实验测的起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| NH3 | N2 | H2 | ||
| ① | 2 | 0 | 0 | 吸收热量akJ |
| ② | 0 | 1 | 3 | 放出热量bkJ |
| ③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是
A.热量关系:a=b
B.反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
C
解析试题分析:A、反应①②平衡状态相同,但加入物质不同,热量关系为:a+b=92.4,错误;B、3个反应温度相同,所以平衡常数相等,错误;C、反应③加入的反应物是反应①的2倍,在等温等容的条件下,容器③的压强大,平衡向左移动,所以达平衡时H2的体积分数:①>③,正确;D、根据质量守恒定律,气体的质量不变,容器恒容,所以密度是一个定值,密度不变不能说明反应已达到平衡,错误。
考点:本题考查化学反应的热效应、平衡常数的判断、化学平衡的判断、化学平衡移动。

在容积一定的密闭容器中,进行可逆反应N2(g)+3H2(g) 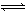 2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是
2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是
| A.T2<T1 |
| B.P2>P1 |
| C.若P3<P4,y轴表示N2的转化率 |
| D.若P3>P4,y轴表示NH3的体积分数 |
金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)==Sn(s)+2CO(g)↑,反应过程中能量的变化如图所示。下列有关该反应的ΔH、ΔS的说法中正确的是
| A.ΔH<0 ΔS<0 | B.ΔH>0 ΔS<0 |
| C.ΔH<0 ΔS>0 | D.ΔH>0 ΔS>0 |
以下各条件的改变可确认发生了化学平衡移动的是 ( )
| A.化学反应速率发生了改变 |
| B.有气态物质参加的可逆反应达到平衡后,改变了压强 |
| C.由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 |
| D.可逆反应达到平衡后,加入了催化剂 |
某兴趣小组为探究外界条件对可逆反应A(g)+B(g) C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
针对上述系列实验,下列结论中错误的是( )
| | A | B | C |
| Ⅰ | 0.050mol·L-1 | 0.050mol·L-1 | 0.050mol·L-1 |
| Ⅱ | 0.070mol·L-1 | 0.070mol·L-1 | 0.098mol·L-1 |
| Ⅲ | 0.060mol·L-1 | 0.060mol·L-1 | 0.040mol·L-1 |
| Ⅳ | 0.080mol·L-1 | 0.080mol·L-1 | 0.12mol·L-1 |
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,只能通过压缩容器的体积才可以实现
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应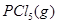
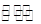
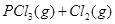 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50s的平均速率为
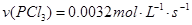
B.保持其他条件不变,升高温度,平衡时,
 ,则反应的
,则反应的
C.相同温度下,起始时向容器中充入
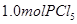 、
、 和
和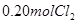 ,达到平衡前v(正)>v(逆)
,达到平衡前v(正)>v(逆)D.相同温度下,起始时向容器中充入
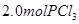 、
、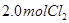 ,达到平衡时,
,达到平衡时, 的转化率小于80%
的转化率小于80%  xC(g) △H<0测得两容器中c(A)随时间t的变化如图所示。
xC(g) △H<0测得两容器中c(A)随时间t的变化如图所示。
 3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L。下列判断中正确的是
3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L。下列判断中正确的是 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )