题目内容
7.常温常压下,下列表示溶液中粒子浓度或物质的量和各种关系中,正确的是( )| A. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+ )=3[c(HC2O4- )+c(C2O42-)+c(H2C2O4)] | |
| B. | pH=4.3的NaHC2O4溶液中:c(Na+ )>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| C. | 0.10mol•L-1NaHCO3溶液中:c(Na+ )+c(H+ )=c(OH- )+c(HCO3-)+c(CO32-) | |
| D. | 0.10mol•L-1 NaHCO3溶液加水稀释后,n(H+ )与n(OH- )的乘积不变 |
分析 A.根据等物质的量的NaHC2O4和Na2C2O4的溶液中的物料守恒分析;
B.NaHC2O4溶液的pH=4.3,溶液显示酸性,说明HC2O4-的电离程度大于其水解程度,据此判断各粒子浓度大小;
C.溶液中一定满足电荷守恒,根据碳酸氢钠溶液中的电荷守恒判断;
D.加水稀释后,促进HCO3-水解,溶液中氢氧根离子的物质的量增大,当氢氧根离子浓度减小,再结合水的离子积Kw不变可知氢离子的浓度增大,则离子的物质的量增大,故n(H+ )与n(OH- )的乘积增大.
解答 解:A.含等物质的量的NaHC2O4和Na2C2O4的溶液,根据物料守恒可得::2c(Na+ )=3[c(HC2O4- )+c(C2O42-)+c(H2C2O4)],故A正确;
B.pH=4.3的NaHC2O4溶液,溶液显示酸性,说明HC2O4-的电离程度大于其水解程度,则c(C2O42-)>c(H2C2O4),溶液中正确的浓度关系为:c(Na+ )>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故B错误;
C.根据NaHCO3溶液中的电荷守恒可得:c(Na+ )+c(H+ )=c(OH- )+c(HCO3-)+2c(CO32-),故C错误;
D.常温下,加水稀释碳酸氢钠溶液后,促进HCO3-水解,n(OH-)增大,由于c(OH-)减小,由Kw不变可知c(H+)增大,则n(H+)增大,则n(H+)与n(OH-)的乘积变大,故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确物料守恒、电荷守恒、质子守恒及盐的水解原理的应用为解答关键,D为易错点,注意稀释后氢离子和氢氧根离子的数目都增大.

练习册系列答案
相关题目
18.化学与生活、社会可持续发展密切相关.下列有关叙述不正确的是( )
| A. | 发生铅中毒时,可喝大量的牛奶或鸡蛋清来缓解病情 | |
| B. | CO2的水溶液呈酸性,CO2的大量排放会导致酸雨的形成 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 |
15.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+ (对苯醌)═N2H4+
(对苯醌)═N2H4+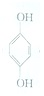 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为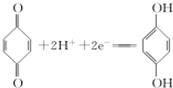 .
.
(2)25℃时.将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当混合溶液中,c(NH4+)=c(Cl-)时.则溶液的pH=7.
②当混合溶液中,c(NH4+)>c(Cl-)时.则反应的情况可能为a.
a.盐酸不足.氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K值和温度的关系如下:
①写出该反应的化学平衡常数的表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,b小于(填“大于”、“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)小于(填“大于”、“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+
 (对苯醌)═N2H4+
(对苯醌)═N2H4+ (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为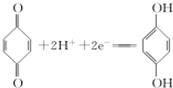 .
.(2)25℃时.将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当混合溶液中,c(NH4+)=c(Cl-)时.则溶液的pH=7.
②当混合溶液中,c(NH4+)>c(Cl-)时.则反应的情况可能为a.
a.盐酸不足.氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)小于(填“大于”、“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
2.常温时在指定条件下的溶液中,下列各组粒子一定能大量共存的是( )
| A. | 加入Na2O2后的溶液中:K+、AlO2-、NO3-、SO32- | |
| B. | 水电离的c(H+ )=1×10-13 mol•L-1的溶液中:Fe2+、Mg 2+、SO42-、NO3- | |
| C. | 通入足量SO2后的溶液中:Ba2+、Fe2+、H2SO3、Cl- | |
| D. | 0.1mol•L-1 KMnO4酸性溶液中:H2O2、NH4+、Br2、SO4 2- |
12.工业上用CO和H2在一定条件下生产燃料甲醇的反应为:CO(g)+2H2(g)?CH3OH(g).
图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图.
下列说法不正确的是( )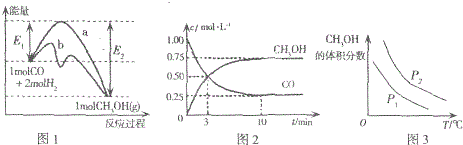
图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图.
下列说法不正确的是( )

| A. | 图1中曲线b表示使用了催化剂;该反应属于放热反应 | |
| B. | 当压强不同(P1<P2)时,平衡时甲醇的体积分数随温度变化的曲线如图3 | |
| C. | 一定温度下,容器中压强恒定时该反应已达平衡状态 | |
| D. | 该温度下CO(g)+2H2(g)?CH3OH(g)的化学平衡常数为10 |
19. 如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
 如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )| A. | c(OH-)大于、小于或等于c(CH3COO-) | B. | c(OH-)一定等于c(CH3COO-) | ||
| C. | c(OH-)一定小于c(CH3COO-) | D. | c(OH-)一定大于c(CH3COO-) |
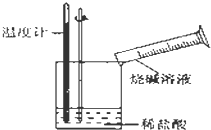 某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化.实验表明:反应温度升高,由此判断该反应是放热(填“吸热”或“放热”)反应,其离子方程式是H++OH-=H2O.
某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化.实验表明:反应温度升高,由此判断该反应是放热(填“吸热”或“放热”)反应,其离子方程式是H++OH-=H2O.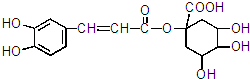 所示:
所示: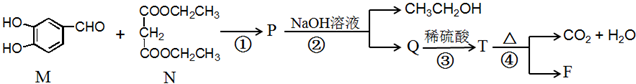

 .
.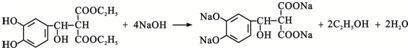 .
. .
.