题目内容
17.水处理技术在生产、生活中应用广泛.(1)根据水中Ca2+、Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用.
①硬水软化的方法通常有热煮沸法、药剂法和离子交换法.离子交换树脂使用了一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力.把CaR2(或MgR2)型树脂置于5%-8%的食盐水中浸泡一段时间,便可再生.
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,洗衣粉洗涤效果较好,原因是肥皂易与Ca2+,Mg2+生成沉淀.
(2)工业上常用绿矾做混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理的水pH调到9左右,再加入绿矾.请解释这一做法的原因:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-=4Fe(OH)3(胶体).(用必要的离子方程式和文字描述).
(3)最近我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是吸附泄漏在河水中的有机物.
分析 (1)①硬水软化的方法通常有①热煮沸法②药剂软化法③蒸馏法④离子交换法⑤电渗析法⑥离子膜电解法;
用磺化煤(NaR)作离子交换剂:2NaR+Ca2+=CaR2+2Na+,2NaR+Mg2+=MgR2+2Na+,用5%-8%的食盐水浸泡可使失去软化能力的磺化煤再生:CaR2+2Na+=2NaR+Ca2+,MgR2+2Na+=2NaR+Mg2+;
②肥皂易与Ca2+,Mg2+生成沉淀,洗涤效果不好;
(2)由于FeSO4•7H2O溶于水后显酸性,而Fe2+在碱性条件下更容易被氧化成Fe3+,所以要将pH调到9左右,变成效果更好的三价铁离子;
(3)活性炭具有吸附性,以此来解答.
解答 解:(1)①硬水软化的方法通常有①热煮沸法②药剂软化法③蒸馏法④离子交换法⑤电渗析法⑥离子膜电解法;用磺化煤(NaR)作离子交换剂:2NaR+Ca2+=CaR2+2Na+,2NaR+Mg2+=MgR2+2Na+,用5%-8%的食盐水浸泡可使失去软化能力的磺化煤再生:CaR2+2Na+=2NaR+Ca2+,MgR2+2Na+=2NaR+Mg2+;
故答案为:热煮沸法;药剂法;5%-8%的食盐水;
②肥皂易与Ca2+,Mg2+生成硬脂酸钙、硬脂酸镁沉淀,洗涤效果不好,洗衣粉不与Ca2+,Mg2+生成沉淀,洗涤效果较好,
故答案为:洗衣粉;肥皂易与Ca2+,Mg2+生成沉淀;
(2)Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)胶体,起到较好的混凝作用,发生的离子反应为4Fe2++O2+2H2O+8OH-=4Fe(OH)3(胶体),
故答案为:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-=4Fe(OH)3(胶体);
(3)活性炭具有吸附性,能吸附泄露在河水中的有机物,故答案为:吸附泄漏在河水中的有机物.
点评 本题考查混合物分离提纯及污水处理,为高频考点,把握物质的性质及混合物分离方法等为解答的关键,侧重分析与实验能力的考查,注重化学与生活的关系,题目难度不大.

| A. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+ )=3[c(HC2O4- )+c(C2O42-)+c(H2C2O4)] | |
| B. | pH=4.3的NaHC2O4溶液中:c(Na+ )>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| C. | 0.10mol•L-1NaHCO3溶液中:c(Na+ )+c(H+ )=c(OH- )+c(HCO3-)+c(CO32-) | |
| D. | 0.10mol•L-1 NaHCO3溶液加水稀释后,n(H+ )与n(OH- )的乘积不变 |
| A. | 原子半径:A<D<C<B | |
| B. | 最简单氢化物的稳定性:D<C | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显碱性 |
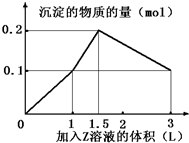 某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )| A. | 氯化铝、氯化铁、氢氧化钠 | B. | 氯化铝、氯化镁、氢氧化钠 | ||
| C. | 偏铝酸钠、氯化钡、硫酸 | D. | 偏铝酸钠、氢氧化钡、硫酸 |
| A. | 向明矾溶液中加入足量的烧碱溶液:Al3++3OH-=Al(OH)3↓ | |
| B. | 在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢铵溶液中滴加足量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 纯碱溶液呈碱性的原因:CO32-+H2O?HCO3-+OH- |
| 选项 | 实 验 目 的 | 实 验 操作 |
| A | 在溶液中将MnO4+完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| B | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 | |
| B. | CO2中含少量SO2,可将该混合气体通入足量的饱和NaHCO3溶液中除去SO2 | |
| C. | 用洁净的铂丝蘸取某食盐,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐中不含KIO3 | |
| D. | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由浅红色变成红色,冷却后溶液由红色变成淡红色,说明HCO3-在水溶液中存在水解平衡 |
