题目内容
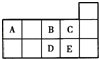
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。回答问题:
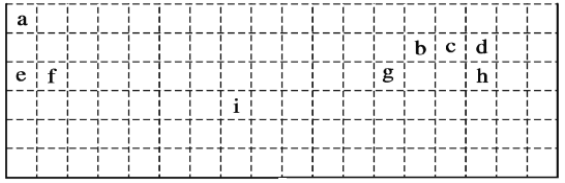
(1)有人认为在元素周期表中,有一种元素也可以放在第ⅦA族,你认为该元素为___(填元素符号)。
(2)实验室制ca3的化学反应方程式为_______________。
(3)g的氧化物与e的最高价氧化物对应水化物反应的离子方程式为_____________。
(4)设计实验验证b、c非金属性的强弱 _________________。
(5)i在周期表中的位置为___。i对应的单质与h对应的单质反应的化学方程式为_________。
(6)e2d2的电子式为______;用电子式表示fCl2的形成过程________________。
(7)写出工业冶炼元素g的单质的化学方程式___________________。
【答案】H Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑ Al2O3 + 2OH- + 3H2O = 2[Al(OH)4]- 对应氢化物的稳定性,最高价氧化物对应水化物的酸性等 第四周期第Ⅷ族 Fe + S
CaCl2+2H2O+2NH3↑ Al2O3 + 2OH- + 3H2O = 2[Al(OH)4]- 对应氢化物的稳定性,最高价氧化物对应水化物的酸性等 第四周期第Ⅷ族 Fe + S ![]() FeS
FeS ![]()
![]() 2Al2O3(熔融)
2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
【解析】
根据周期表的结构,可知从a到i各元素分别为H、C、N、O、Na、Mg、Al、Fe。
(1)氢元素最外层有1个电子,可以得到1个电子达到2电子稳定结构(当原子核外只有1层电子时,排布2个电子是稳定结构),从而形成-1价,第ⅦA族元素也可以得到1个电子形成-1价,所以H也可以放在第ⅦA族。
(2)实验室用NH4Cl和Ca(OH)2混合加热制取NH3,化学反应方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
(3)Al的氧化物Al2O3是两性氧化物,可以与Na的最高价氧化物对应水化物NaOH反应,离子方程式为Al2O3 + 2OH- + 3H2O = 2[Al(OH)4]-。
(4)非金属性的强弱可以用对应氢化物的稳定性或最高价氧化物对应水化物的酸性强弱来判断,如可以把稀硝酸加入碳酸钠溶液中,产生气体,证明硝酸酸性强于碳酸,从而证明非金属性:N>C。
(5)Fe在周期表中位于第四周期第Ⅷ族。铁与硫反应生成硫化亚铁,化学方程式为Fe + S ![]() FeS。
FeS。
(6)Na2O2是离子化合物,阳离子是Na+,阴离子是O22-,其电子式为![]() ;用电子式表示MgCl2的形成过程为
;用电子式表示MgCl2的形成过程为![]() 。
。
(7)工业上用电解熔融的氧化铝冶炼Al单质,化学方程式为2Al2O3(熔融) 4Al+3O2↑。
4Al+3O2↑。

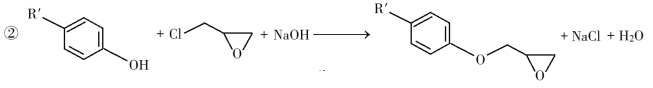
【题目】有机化工中3,5-二甲氧基苯酚是重要的有机合成中间体,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)1mol间苯三酚完全燃烧需要_____molO2。
(2)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是________。
②萃取用到的分液漏斗分液时有机层在分液漏斗的____填(“上”或“下”)层。
(3)分离得到的有机层依次用饱和NaHCO3溶液、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是__________________________ ;
(4)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_________(填字母)。
a.蒸馏除去乙醚 b.冷却结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(5)写出反应中可能出现的副产物结构简式______________(只要写一种即可)。