题目内容
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:

回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。

(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为________。
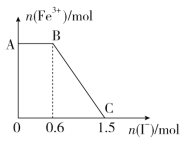
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。

①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(Na2S)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为___________,与粗硒中铁含量为0.89%相比,铁含量明显降低。
【答案】温度升高,单质硫在煤油中的溶解度增加 95℃ 4ClO3-+ 4H+ + Se = 4ClO 2↑+ H2O + H2SeO3 ClO2 + 4H+ + 5e- = Cl- + 2H2O 0.345 5.0×10-35 mol·L-1 Na2SeSO3 + H2SO4 = Na2SO4 + Se↓+ SO2↑+ H2O 3.2×10-3 %
【解析】
硒酸泥(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)加入热煤油萃取硫,固体加入稀硫酸、氯酸钠进行氧化,过滤,滤渣中含有氢氧化铁、二氧化硅,氧化浸出液含有H2SeO3,控制电位还原,发生氧化还原反应可生成Se。
(1)“脱硫”时,脱硫率随着温度的升高,脱硫率呈上升趋势,其原因是温度升高,单质硫在煤油中的溶解度增加。最佳温度是95℃。
(2)“氧化酸浸”中,固体加入稀硫酸、氯酸钠进行氧化,Se转化成H2SeO3,ClO3-还原成ClO 2,该反应的离子方程式为4ClO3-+ 4H+ + Se = 4ClO 2↑+ H2O + H2SeO3 。
(3)①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2,ClO2得电子还原成Cl-,该过程的还原反应(半反应)式为ClO2 + 4H+ + 5e- = Cl- + 2H2O。
②为使硒和杂质金属分离,确保Cu2+、Zn2+、Fe2+不被还原,用亚硫酸钠还原时的最低电位应控制在0.345V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(Na2S)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为c(Cu2+)=![]() =
=![]() =5.0×10-35 mol·L-1 ,精硒中基本不含铜。
=5.0×10-35 mol·L-1 ,精硒中基本不含铜。
②硒代硫酸钠酸化生成硒、二氧化硫和水,化学方程式为Na2SeSO3 + H2SO4 = Na2SO4 + Se↓+ SO2↑+ H2O 。
(5)精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数==![]() 3.2×10-3 %,与粗硒中铁含量为0.89%相比,铁含量明显降低。
3.2×10-3 %,与粗硒中铁含量为0.89%相比,铁含量明显降低。

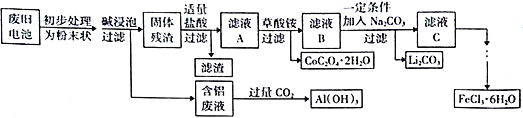
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________________________________________。
(2)从含铝废液得到Al(OH)3的离子反应方程式为__________________________________。
(3)滤液A中的溶质除HCl、LiCl外还有__________(填化学式)。写出LiCoO2和盐酸反应的化学方程式__________________________________。
(4)滤渣的主要成分为____________________(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120-220 | CoC2O4·2H2O | 19.67% |
Ⅱ | 300~350 | _________________________ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为___________mol·L-1
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是_________________________。