题目内容
【题目】在298 K时,1 mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8 kJ。
(1)写出该反应的热化学方程式:________________________________________。
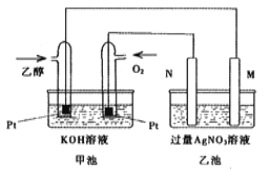
(2)如图将此反应设计为原电池,乙池中的两个电极一个是石墨电极,一个是铁电极。工作时M、N两个电极的质量都不减少,乙池中总反应的化学方程式为:_________________,一段时间后,测得乙池中某一电极质量增加4.32g时,理论上甲池消耗氧气体积为(标准状况)__________mL。
【答案】C2H5OH(l)+3O2(g)=2CO2 (g)+3H2O(l) △H=-1366.8 kJ·mol-1 4AgNO3 + 2H2O![]() 4Ag + O2 ↑+ 4HNO3 224
4Ag + O2 ↑+ 4HNO3 224
【解析】
(1)书写热化学方程式一定要注意标明物质的聚集状态,反应热的单位要写清楚;
(2)由图可知,甲池为原电池,通入乙醇的电极是负极,通入氧气的电极是正极,乙池为电解池,根据图片知,N是阳极,M是阴极,工作时M、N两个电极的质量都不减少,则M电极是铁,N电极是石墨。
(1)1mol乙醇(C2H5OH)完全燃烧并生成二氧化碳和液态水时,放出热量为1366.8kJ,燃烧热的热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8 kJmol-1,故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8 kJmol-1;
(2)乙池为电解池,阳极N极上水失电子发生氧化反应生成氧气,电极反应式为4OH—-4e—=O2↑+2H2O,阴极M上银离子得电子发生还原反应生成银,电极反应式为为Ag++e—=Ag,则电解总反应的化学方程式为4AgNO3 + 2H2O![]() 4Ag + O2↑+ 4HNO3;4.32gAg的物质的量为
4Ag + O2↑+ 4HNO3;4.32gAg的物质的量为![]() =0.04mol,由得失电子数目守恒可知上甲池消耗氧气体积V(O2)=
=0.04mol,由得失电子数目守恒可知上甲池消耗氧气体积V(O2)=![]() ×0.04mol×22.4L/mol=0.224L=224ml,故答案为:4AgNO3 + 2H2O
×0.04mol×22.4L/mol=0.224L=224ml,故答案为:4AgNO3 + 2H2O![]() 4Ag + O2↑+ 4HNO3;224。
4Ag + O2↑+ 4HNO3;224。

 口算能手系列答案
口算能手系列答案【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大___min(填0~1、1~2、2~3、3~4、4~5),原因是____。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是(________)
A.蒸馏水
B.KCl溶液
C.KNO3溶液
D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
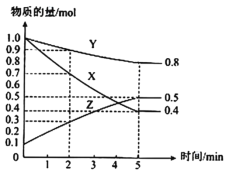
①该反应的化学方程式是___。
②该反应达到平衡状态的标志是___。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成1molY的同时生成2molZ
③2min内X的转化率为___。