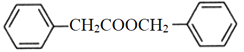题目内容
【题目】Ⅰ![]() 利用下图装置验证同主族元素非金属性的变化规律。
利用下图装置验证同主族元素非金属性的变化规律。
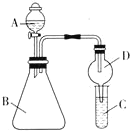
(1)若要证明非金属性:Cl>I,A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气![]() ,C中加淀粉碘化钾溶液,观察到C溶液中的现象是__________,即可证明。可用__________溶液吸收尾气。
,C中加淀粉碘化钾溶液,观察到C溶液中的现象是__________,即可证明。可用__________溶液吸收尾气。
(2)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,观察到C中溶液的现象是__________,即可证明。但有的同学认为盐酸具有挥发性,应用__________溶液除去。
Ⅱ![]() 利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
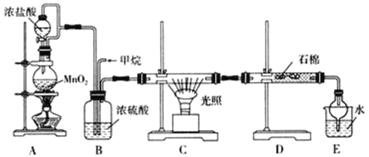
(1)A中制取氯气反应的化学方程式是_______________。
(2)D装置中的石棉上吸附着潮湿的KI粉末,其作用是__________。
(3)E装置的作用是_________(填序号)。
A.收集气体 B. 吸收氯气 C.吸收氯化氢
(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是__________。
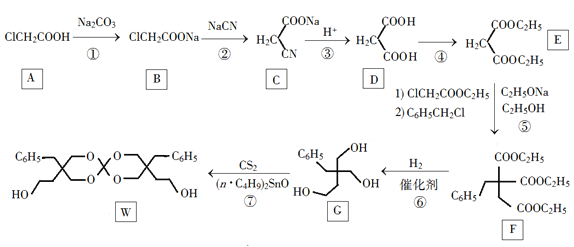
(5) 将1molCH4与Cl2发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是____。
【答案】无色溶液变蓝 NaOH 生成白色沉淀 饱和碳酸氢钠 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 除去Cl2 C 分液 2.5mol
MnCl2+Cl2↑+2H2O 除去Cl2 C 分液 2.5mol
【解析】
I.(1)根据非金属性越强单质的氧化性越强分析;
(2)根据非金属性越强最高价氧化物的酸性越强分析;
Ⅱ.本实验的目的是利用甲烷与氯气发生取代反应的副产品生产盐酸,首先在装置A中利用浓盐酸和二氧化锰共热制取氯气,甲烷和生成的氯气经浓硫酸干燥后通入B装置在光照条件下发生取代反应,D中用吸附着潮湿的KI粉末的石棉吸收未反应的氯气,装置E中用水吸收生成的HCl气体,同时有取代反应的有机产物冷凝,与生成的盐酸分层,可分液分离得到盐酸;HCl极易溶于水,干燥管可以防止倒吸。
I.(1)浓盐酸和高锰酸钾反应生成的氯气进入装置C中,根据非金属性越强单质的氧化性越强可知,若氯气将淀粉碘化钾溶液中的碘离子氧化成碘单质,则可以证明Cl的非金属性更强,而淀粉遇碘变蓝,所以当观察到无色溶液变蓝,即可证明非金属性Cl>I;氯气可以和NaOH反应,所以可以用NaOH溶液吸收尾气;
(2)盐酸可以和碳酸钙反应生成二氧化碳,二氧化碳进入C装置,根据非金属性越强,最高价氧化物的酸性越强,若装置C中生成硅酸,则可证明非金属C>Si,而硅酸不溶于水,所以观察到C中生成白色沉淀,即可证明;二氧化碳中混有的HCl气体可用饱和碳酸氢钠溶液除去;
Ⅱ.(1)浓盐酸和二氧化锰共热生成氯气的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)潮湿的KI粉末可用除去HCl中未反应的Cl2;
(3)E装置的作用是吸收反应生成的HCl,所以选C;
(4)生成的有机物与盐酸不互溶,所以可以分液分离得到盐酸;
(5)将1molCH4与Cl2发生取代,测得4种有机取代物的物质的量相等,即生成的CH3Cl、CH2Cl2、CHCl3、CCl4均为0.25mol,根据元素守恒可知Cl原子为2.5mol,取代反应中有一个氯原子取代一个氢原子的同时还会生成一个HCl,所以HCl还有2.5molCl原子,所以消耗的氯气的物质的量为2.5mol。

【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D