题目内容
【题目】I.下列实验不可行的是___________________________。
①将![]() 与NaOH的醇溶液共热制备CH3—CH═CH2
与NaOH的醇溶液共热制备CH3—CH═CH2
②向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,检验混合物中是否含有甲醛
③向丙烯醛(CH2=CH—CHO)中滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
④为验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再滴入几滴硝酸银溶液,观察现象
II.苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一,可采用苯乙腈为原料在实验室进行合成。请回答:
(1)制备苯乙酸的装置如图(加热和夹持装置等略)。已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。

在250mL三口瓶a中加入70mL质量分数为70%的硫酸,加热至100℃,再缓缓滴入40g苯乙腈,然后升温至130℃,发生反应:
![]()
仪器b的名称是______________。反应结束后加适量冷水再分离出苯乙酸粗品,加入冷水的目的是___________________________________。
(2)分离出粗苯乙酸所用到的仪器是(填字母)__________________。
a.漏斗 b.分液漏斗 c.烧杯 d.玻璃棒 e.直形冷凝管
(3)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤,滤液静置一段时间可以析出苯乙酸铜晶体,写出发生反应的化学方程式__________________,混合溶剂中乙醇的作用是_____________________________________________。
【答案】 ①②③④ 冷凝管 降低溶解度,使苯乙酸结晶 acd 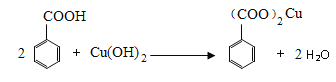 增大苯乙酸的溶解度,便于充分反应
增大苯乙酸的溶解度,便于充分反应
【解析】本题考查有机化学实验,涉及除杂、检验、制备等方面。
I. ①醇类物质在NaOH的醇溶液共热的条件不能发生反应,条件应为浓硫酸并加热,故①错误;②向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,生成甲酸钠,甲酸钠中含有醛基,加入新制的氢氧化铜加热,甲酸钠会和其反应出现砖红色沉淀,这样甲醛存在与否不能确定,故②错误;③丙烯醛(CH2=CH—CHO)中碳碳双键及醛基均可使KMnO4(H+)溶液褪色,故③错误;④为验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再滴入足量用硝酸中和氢氧化钠后再滴入几滴硝酸银溶液,观察现象,故④错误; II. (1)仪器b的名称是冷凝管(球形冷凝管);反应结束后加适量冷水,降低温度,减少苯乙酸的溶解度,便于苯乙酸(微溶于冷水)结晶析出,(2)析出苯乙酸晶体通过过滤能从混合液中分离出苯乙酸粗品,过滤所用的仪器主要有漏斗、玻璃棒、烧杯等,故选acd;(3)苯乙酸与Cu(OH)2发生中和反应,其反应方程式为:![]() ;苯乙酸微溶于冷水,溶于乙醇,混合溶剂中乙醇可以增大苯乙酸的溶解度,然后与Cu(OH)2反应除去苯乙酸,故混合溶剂中乙醇的作用是大苯乙酸的溶解度,便于充分反应。
;苯乙酸微溶于冷水,溶于乙醇,混合溶剂中乙醇可以增大苯乙酸的溶解度,然后与Cu(OH)2反应除去苯乙酸,故混合溶剂中乙醇的作用是大苯乙酸的溶解度,便于充分反应。

【题目】(1)已知NO2和N2O4的结构式如右图所示。已知:N—N的键能为a kJ/mol,NO2和N2O4中N=O键键能分别是b kJ/mol和c kJ/mol。写出NO2转化为N2O4的热化学方程式________________(△H用a、b、c的代数式表示)。

(2)在100℃时,将0.4mol NO2放入2L的真空容器中发生反应:2NO2![]() N2O4。测得容器内气体的物质的量随时间变化如下表:
N2O4。测得容器内气体的物质的量随时间变化如下表:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①上述条件下,前20s内以NO2表示的平均化学反应速率为_________________________;达到平衡状态时,NO2的转化率是________。
②n2_______ n3(填“>”、“=”、“<”)。
③80s时,向容器内加入NO2和N2O4各0.24mol,化学平衡将_________(填“向正反应方向移动”、“ 向逆反应方向移动”、“不移动”)。
④若将NO2的起始物质的量改为0.2mol,在相同条件下进行实验,要想达到与上述平衡相同的平衡状态,则起始时还需要加入适量的N2O4气体,则N2O4的浓度为_____________。





