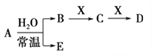题目内容
【题目】下列有关说法不正确的是( )
A.沿海城市建筑时直接从海洋里取用海沙,可以大大降低成本
B.“地沟油”禁止使用,但处理后可以制生物柴油和肥皂
C.乙醇溶液、双氧水均可用于杀菌消毒,但原理不同
D.维生素C和铁粉是常用的抗氧化剂
【答案】A
【解析】
试题分析:A.不能直接从海洋里取用海沙用于城市建筑,故A错误;B.将“地沟油处理后可以制生物柴油和肥皂,故B正确;C.乙醇溶液使蛋白质变性和双氧水可利用氧化性使蛋白质变性,均可杀菌消毒,但原理不同,故C正确;D.维生素C和铁粉均有强还原性,是常用的抗氧化剂,故D正确;答案为A。

练习册系列答案
相关题目