题目内容
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第______周期第_______族。
(2)E元素形成的氧化物对应的水化物的化学式为______。
(3)元素B、C、D、E形成的简单离子半径大小关系是_________。(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:_________。
(5)由A、B、C三种元素形成的离子化合物的化学式为_________,它与强碱溶液共热,发生反应的离子方程式是_________。
(6) D2EC3一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为
_________。(化学式用具体的元素符号表示)。
(7)E的某种氧化物是大气污染物之一,也是某工业生产中的主要尾气之一。某校兴趣小组欲采用下列方案测定此工业尾气中的E的氧化物的含量。
 通过的尾气体积为VL(已换算成标准状况)时,该尾气中E的氧化物含量(体积分数)为_______(用含有V、m的代数式表示).
通过的尾气体积为VL(已换算成标准状况)时,该尾气中E的氧化物含量(体积分数)为_______(用含有V、m的代数式表示).
【答案】 二 VA H2SO3 H2SO4 S2- N3- O2- Na+ 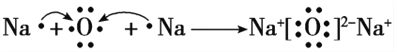 NH4NO3 NH4++OH-
NH4NO3 NH4++OH-![]() NH3↑+H2O 4Na2SO3=Na2S+3Na2SO4 22.4m/233V
NH3↑+H2O 4Na2SO3=Na2S+3Na2SO4 22.4m/233V
【解析】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,则A为H元素;B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,B元素的原子半径是其所在主族中最小的,应为N元素;C元素原子的最外层电子数比次外层多4个,只能有2个电子层,最外层电子数为6,应为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,D为Na元素;C、E主族,则E为S元素。即A是氢元素,B是氮元素,C是氧元素,D钠元素,E是硫元素。
(1)B是氮,在周期表中的位置为第二周期第ⅤA族。(2)E元素是硫,形成的氧化物SO2、SO3对应的水化物的化学式为 H2SO3 、H2SO4 ;(3)元素B、C、D、E形成的简单离子S2― 有三个电子层,N3- O2- Na+ 只有两处电子层,且电子层结构相同,核电荷大的半径反而小,半径大小关系是S2- N3- O2- Na+ ;(4)用电子式表示化合物D2C即Na2O的形成过程,Na最外层一个电子易失去,氧最外层6个电子,易得到2个电子形成稳定结构,![]() ,(5)由A、B、C三种元素即H、N、O形成的离子化合物的化学式为NH4NO3 它是铵盐,与强碱溶液共热,发生反应生成NH3,离子方程式是NH4++OH-
,(5)由A、B、C三种元素即H、N、O形成的离子化合物的化学式为NH4NO3 它是铵盐,与强碱溶液共热,发生反应生成NH3,离子方程式是NH4++OH-![]() NH3↑+H2O ;(6) D2EC3即Na2SO3一定条件下可以发生分解反应生成两种盐,其中一种是无氧酸盐,是Na2S,化学方程式4Na2SO3=Na2S+3Na2SO4 ;(7)mg是硫酸钡的质量,硫酸钡的物质的量为 mg/233g·mol-1 = m/233 mol,根据硫元素守恒可知二氧化硫的体积为 m/233 mol×22.4L·mol-1= 22.4m/233 L,故尾气中二氧化硫的体积分数 22.4m/233 L/VL = 22.4m/233V ;
NH3↑+H2O ;(6) D2EC3即Na2SO3一定条件下可以发生分解反应生成两种盐,其中一种是无氧酸盐,是Na2S,化学方程式4Na2SO3=Na2S+3Na2SO4 ;(7)mg是硫酸钡的质量,硫酸钡的物质的量为 mg/233g·mol-1 = m/233 mol,根据硫元素守恒可知二氧化硫的体积为 m/233 mol×22.4L·mol-1= 22.4m/233 L,故尾气中二氧化硫的体积分数 22.4m/233 L/VL = 22.4m/233V ;

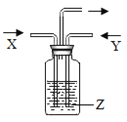
【题目】气体X和气体Y通入液体Z的洗气瓶中(如图),一定没有沉淀生成的是( )
X | Y | Z |
| |
A | NO2 | SO2 | BaCl2 | |
B | NH3 | Cl2 | Fe2(SO4)3 | |
C | NH3 | CO2 | NaCl | |
D | CO2 | SO2 | CaCl2 |
A. A B. B C. C D. D