题目内容
(17分)合成氨工业上常用下列方法制备H2:
方法:
方法:

试计算25℃时由方法②制备l000g H2所放出的能量为_________ kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应: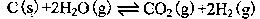 其相关数据如下表所示:
其相关数据如下表所示: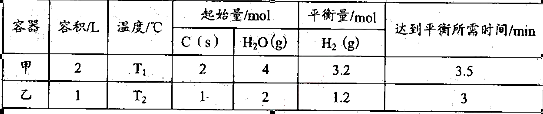
①T1_________T2(填“>”、“=”或“<”);
T1℃时,该反应的平衡常数K="_________" 。
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是_________。
③一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_________。
A.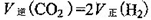
B.混合气体的密度保持不变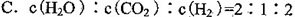
D.混合气体的平均相对分子质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示: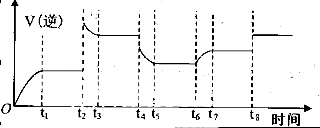
可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O (g)的平衡转化率最低_________,t4时刻改变的条件是__________。
⑤在25 ℃时,c mol/L,的醋酸与0.02mol/L NaOH溶液等体积混合后溶液刚好呈中性,
用含c的代数式表示CH3COOH的电离常数Ka=_________。
(17分)(1)20500kJ (2分)
(2)① > (2分) 12.8(2分)
② <1.4mol/L (2分)
③BD(选全得2分,漏选得1分,有错选0分)
④t7-t8(或“t7到t8”)(2分) 降低温度(2分)
⑤ 2×10-9/(c-0.02) (3分)
解析试题分析:(1)根据盖斯定律得由方法②制取氢气的热化学方程式可由已知中的反应得到,每生成1mol氢气放出的热量=①-②-③=(394-111-242)kJ=41kJ,1000g氢气的物质的量是500mol,所以制备l000g H2所放出的能量为500×41=20500kJ;
(2)①由表中数据可计算各物质的平衡浓度,所以T1的化学平衡常数K1=1.62×0.8/0.42=12.8,同理可计算T2的平衡常数K2=1.35,因为该反应是吸热反应,K1> K2,所以T1>T2
②反应进行到一半时,若按反应速率一直不变计算,1.5min时水蒸气的浓度是2mol/L-0.6mol/L=1.4mol/L,但是反应速率随反应的进行逐渐减小,前一半的反应速率大于后一半的反应速率,所以消耗水蒸气的浓度较大,则剩余水蒸气的浓度应小于1.4mol/L;
③A、平衡时氢气的正反应速率是二氧化碳逆反应速率的2倍,错误;B、该反应有固体参与,所以气体的质量一直在变,当达到平衡时气体的质量不再变化,容器的体积一直不变,所以当气体的密度不变时证明已达平衡状态,正确;C、气体的浓度之比符合化学计量数之比时 不能判断平衡是否到达,错误;D、混合气体的质量与气体的物质的量在未达平衡时一直在变,即气体的平均相对分子质量在变,平衡时混合气体的质量、物质的量均固定,混合气体的平均相对分子质量不再变化,正确,答案选BD;
④H2O (g)的平衡转化率最低,证明平衡一直逆向移动,t2~t4逆反应速率陡然增大后减小至不变,说明改变的一个条件是增大压强,平衡逆向移动;t4~t6逆反应速率陡然减小至不变,说明改变的条件是降低温度,平衡逆向移动;t6~t7逆反应速率先不变再逐渐增大至不变,说明改变的条件是又充入了水蒸气,虽然平衡正向移动,但水蒸气的转化率降低了,所以水蒸气的转化率最低的是t7-t8;t4时刻改变的条件是降低温度;
⑤混合溶液呈中性证明c(OH-)= c(H+)=1×10-7mol/L,根据电荷守恒得c(Na+)=c(CH3COO-)=0.01mol/L,因为醋酸钠溶液呈碱性,现在溶液呈中性,说明醋酸过量,所以剩余醋酸的物质的量浓度是(c-0.02)/2mol/L,则产生的电离平衡常数K= c(H+) c(CH3COO-)/ c(CH3COOH)= 2×10-9/(c-0.02)。
考点:考查化学平衡状态的判断,转化率的判断,对图像的分析,反应热效应的计算,混合溶液的计算

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案(8分) 关于反应热请回答如下问题:
(1)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为 。
(2) 实验测得,向200mL1mol/L的NaOH溶液中加入稀醋酸恰好反应放出Q kJ的热量,请写出热化学反应方程式:_________________________ 。
(3)已知反应CH3—CH3(g)―→CH2=CH2(g)+H2(g),有关化学键的键能如下。
| 化学键 | C—H | C=C | C—C | H—H |
| 键能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
(4)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)
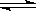 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 。
(15分)氨是最重要的化工产品之一。
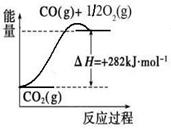
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)  CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。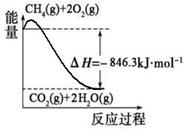

(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO] (l)+CO(g)+NH3(g)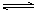 [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0
某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为_________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g)+7O2(g) =6CO(g)+8H2O(g) △H =-2389.8 kJ/mol
②2CO(g) + O2(g) =2CO2(g) △H =-566 kJ/mol
③H2O(l) = H2O(g) △H ="+" 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g) +H2O(g)  CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| | H2O | CO | CO2 | H2 |
| 甲 (质量/g) | 1.8 | 8.4 | a | 1 |
| 乙 (质量/g) | 1.8 | 2.8 | 0 | 0 |
②下图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是 、 (答两个要点即可)。

(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时,溶液中c(HCO3-)∶c(CO32-) = 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) -c(H+) = [用含c(HCO3-)、c(H2CO3)的符号表示]。
(14分)2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要。复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:
⑴火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H="-" 534 kJ·mol-1 ①
H2O2(1)=H2O(1)+1/2O2(g) △H="-" 98.64 kJ·mol-1 ②
H2O(1)=H2O(g) △H=+44kJ·mol-l ③
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H= ,
⑵据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作 原料的燃 料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电,其工作原理如图所示。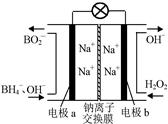
则该电池的正极反应____ ___
⑶H2O2是一种不稳定易分解的物质。右图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图 。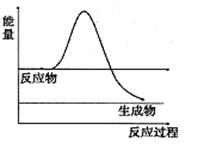
⑷某化学兴趣小组欲测定H2O2的分解速率,取溶液0.5L进行分析,数据如表格所示:
| t(S) | 0 | 2 | 4 | 6 | 8 | 10 |
| n(H2O2) (moL) | 0.8 | 0.7 | 0.62 | 0.55 | 0.27 | 0.03 |
⑸H2O2还是一种药物化学分析的氧化剂,能用于药物的分析。

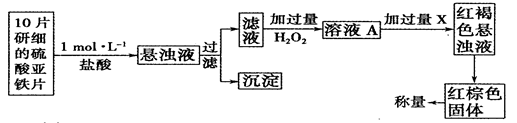
①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。
A.过滤 B.洗涤 C.萃取 D.分液 E.冷却 F.灼烧
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为
_________(小数点后面保留一位有效数字)。
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究.
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)  HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq) I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的化学方程式为__ ____,其反应△H=___ ___
(2)在溶液中存在化学平衡:I2(aq) + I-(aq)  I3-(aq),其平衡常数表达式为_______.
I3-(aq),其平衡常数表达式为_______.
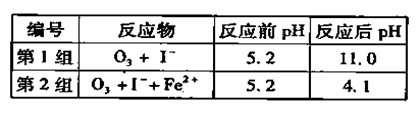
(3)为探究Fe2+ 对O3氧化I-反应的影响(反应体如左图),某研究小组测定两组实验中I3-浓度和体系pH,结果见右图和下表。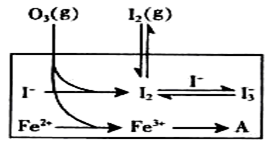
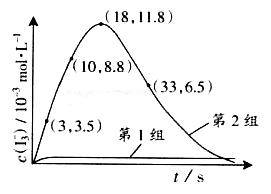
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是 。
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)______。
| A.c(H+)减小 | B.c(I-)减小 | C.I2(g)不断生成 | D.c(Fe3+)增加 |
I.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题:
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以v (CO2)表示的反应速率为 (保留两位小数,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(2)已知在常温常压下:
① 2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g)= H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池某电极的工作原理如下图所示:
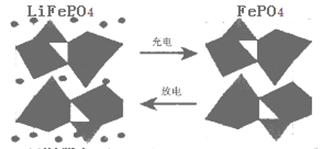
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 L,将电解后的溶液加水稀释至1L,此时溶液的pH= 。
 CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;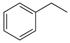 (g)
(g)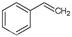 (g)+H2(g),ΔH=" +117.6" kJ/mol。
(g)+H2(g),ΔH=" +117.6" kJ/mol。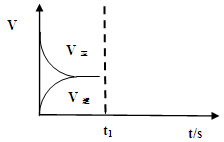
 CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l 则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .