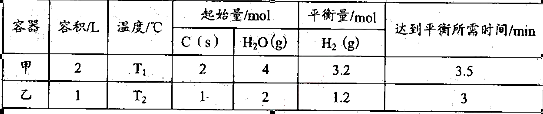
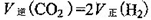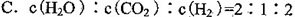题目内容
(8分) 关于反应热请回答如下问题:
(1)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为 。
(2) 实验测得,向200mL1mol/L的NaOH溶液中加入稀醋酸恰好反应放出Q kJ的热量,请写出热化学反应方程式:_________________________ 。
(3)已知反应CH3—CH3(g)―→CH2=CH2(g)+H2(g),有关化学键的键能如下。
| 化学键 | C—H | C=C | C—C | H—H |
| 键能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
(4)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)
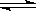 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 。
(1)△H3>△H2>△H1;
(2) NaOH(aq)+CH3COOH(aq) CH3COONa(aq)+H2O(l)△H =-5QkJ/mol ;
CH3COONa(aq)+H2O(l)△H =-5QkJ/mol ;
(3) +125.6 kJ/mol;
(4)4 NH3(g) + 5O2(g) 4NO(g) + 6H2O(g);ΔH ="-" 905.5 kJ·mol-1。
4NO(g) + 6H2O(g);ΔH ="-" 905.5 kJ·mol-1。
解析试题分析:(1)浓硫酸溶于水放热,醋酸为弱电解质,反应过程中醋酸发生电离,电离吸热,反应热为负值,放出的热量越多,则△H越小,则△H3>△H2>△H1;(2) 实验测得,向200mL1mol/L的NaOH溶液中加入稀醋酸恰好反应放出Q kJ的热量,热化学反应方程式:NaOH(aq)+CH3COOH(aq) CH3COONa(aq)+H2O(l)△H =-5QkJ/mol;(3)根据反应热等于反应物的键能之和减去生成物的键能之和进行计算。该反应的反应热=(6×414.4+347.4)-(4×414.4+615.3+435.3)="+125.6" kJ/mol;(4)①N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol;②N2(g)+3H2(g)
CH3COONa(aq)+H2O(l)△H =-5QkJ/mol;(3)根据反应热等于反应物的键能之和减去生成物的键能之和进行计算。该反应的反应热=(6×414.4+347.4)-(4×414.4+615.3+435.3)="+125.6" kJ/mol;(4)①N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol;②N2(g)+3H2(g) 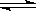 2NH3(g) △H=-92.4kJ/mol③2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol。根据盖斯定律:①×2+③×3-②×2得氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为4 NH3(g) + 5O2(g)
2NH3(g) △H=-92.4kJ/mol③2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol。根据盖斯定律:①×2+③×3-②×2得氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为4 NH3(g) + 5O2(g) 4NO(g) + 6H2O(g);ΔH ="-" 905.5 kJ·mol-1。
4NO(g) + 6H2O(g);ΔH ="-" 905.5 kJ·mol-1。
考点:考查反应热的比较、热化学方程式书写、反应热的计算、盖斯定律。

含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 | 36.1 |
| *燃烧热/kJ·mol-1 | 1 560.7 | 2 219.2 | 2 877.6 | 3 535.6 |
*燃烧热:1 mol物质完全燃烧,生成二氧化碳、液态水时所放出的热量。
根据表中数据,下列判断错误的是
A.正庚烷在常温常压下肯定不是气体
B.随碳原子数增加,烷烃沸点和燃烧热都成比例增加
C.随碳原子数增加,烷烃沸点逐渐升高
D.烷烃燃烧热随所含碳原子数增加而增加
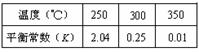
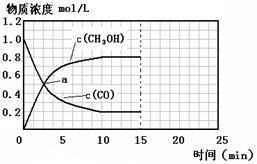
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
(1)写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
(2)对反应Ⅰ,在一定温度下反应达到平衡的标志是 (选填编号)
a.反应物不再转化为生成物 b.平衡常数K不再增大
c.CO2的转化率不再增大 d.混合气体的平均相对分子质量不再改变
(3)在密闭容器中,反应Ⅰ在一定条件达到平衡后,其它条件恒定,能提高CO2转化率的措施是 (选填编号)
| A.降低温度 | B.补充CO2 | C.加入催化剂 | D.移去甲醇 |
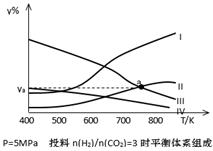
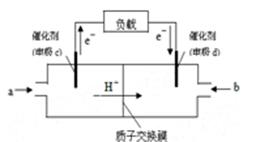
(5)一种以甲醇作燃料的电池示意图如图。写出该电池放电时负极的电极反应式: 。
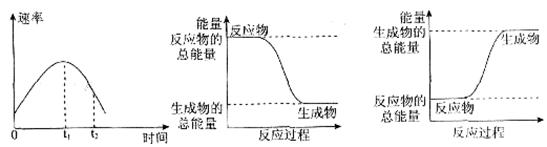
 H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则: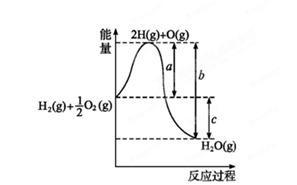
 O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1 CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1 CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。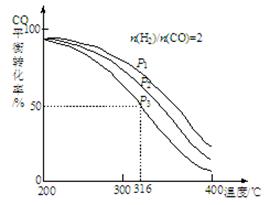




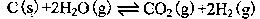 其相关数据如下表所示:
其相关数据如下表所示: