题目内容
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究.
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)  HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq) I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的化学方程式为__ ____,其反应△H=___ ___
(2)在溶液中存在化学平衡:I2(aq) + I-(aq)  I3-(aq),其平衡常数表达式为_______.
I3-(aq),其平衡常数表达式为_______.
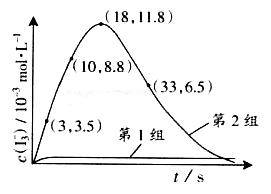
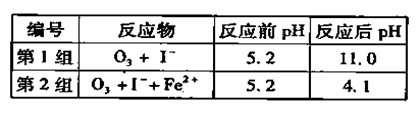
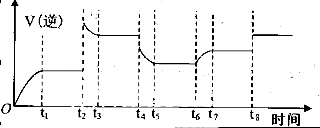
(3)为探究Fe2+ 对O3氧化I-反应的影响(反应体如左图),某研究小组测定两组实验中I3-浓度和体系pH,结果见右图和下表。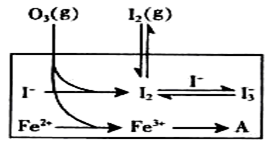
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是 。
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)______。
| A.c(H+)减小 | B.c(I-)减小 | C.I2(g)不断生成 | D.c(Fe3+)增加 |
(1) O3+2Ⅰ—+2H+=Ⅰ2+ O2+ H2O,△H=△H1+△H2+△H3。
(2) 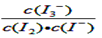
(3)①反应过程中消耗氢离子,溶液酸性减弱,pH增大,水电离出氢离子参与反应破坏水的电离平衡,氢氧根浓度增大,溶液呈碱性,pH增大;
②Fe2+,因为Fe3+可以将I-直接氧化成I2,使溶液中c(I2)增大,促使I2(aq)+I-(aq) I3-(aq)的平衡右移,消耗的c(I-)增多,提高Ⅰ-的转化率。
I3-(aq)的平衡右移,消耗的c(I-)增多,提高Ⅰ-的转化率。
③BC
(4)(计算过程略)5.5×10—4 mol/L·s
解析试题分析:(1)①②③3步反应的方程式相加可得总方程式:O3+2Ⅰ—+2H+=Ⅰ2+ O2+ H2O;根据盖斯定律可得:△H=△H1+△H2+△H3。
(2)根据平衡常数的定义可得I2(aq) + I-(aq)  I3-(aq),平衡常数表达式为
I3-(aq),平衡常数表达式为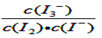 。
。
(3)①第1组实验中,O3氧化I?的离子方程式为:O3+2Ⅰ—+2H+=Ⅰ2+ O2+ H2O,反应过程中消耗氢离子,溶液酸性减弱,pH增大,水电离出氢离子参与反应破坏水的电离平衡,氢氧根浓度增大,溶液呈碱性,pH增大。
②因为Fe3+的氧化性大于I2,Fe3+可以将I-直接氧化成I2发生反应:2Fe3++2I-==2Fe2++I2,所以A为Fe2+,因为该反应生成了I2,使溶液中c(I2)增大,进而使I2(aq)+I-(aq) I3-(aq)的平衡右移,二者导致消耗的c(I-)增多,所以I?的转化率增大。
I3-(aq)的平衡右移,二者导致消耗的c(I-)增多,所以I?的转化率增大。
③对比表格中第1、2组实验前后pH可得,第1组pH增大,c(H+)减小,图中第1组实验所得I3-浓度曲线先略为增大后几乎不变,第2组pH减小,c(H+)增大,图中第2组实验所得I3-浓度曲线先显著增大后逐渐减小至无,根据上述分析可得,若c(H+)减小,I3-浓度不会下降,A项错误;若c(I-)减小,则反应③HOI(aq)+I-(aq)+H+(aq)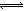 I2(aq)+H2O(l)的平衡左移,c(I2)也减小,导致I2(aq)+I-(aq)
I2(aq)+H2O(l)的平衡左移,c(I2)也减小,导致I2(aq)+I-(aq)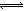 I3-(aq)的平衡左移,所以I3-浓度下降,B项正确;若I2(g)不断生成,导致I2(aq)减小,使 I2(aq)+I-(aq)
I3-(aq)的平衡左移,所以I3-浓度下降,B项正确;若I2(g)不断生成,导致I2(aq)减小,使 I2(aq)+I-(aq)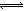 I3-(aq)的平衡左移,则I3-浓度下降,C项正确;若c(Fe3+)增加,Fe3+将I-氧化成I2,则溶液中c(I2)增大,而海水中c(I-)略为减小或忽略不计,导致I2(aq)+I-(aq)
I3-(aq)的平衡左移,则I3-浓度下降,C项正确;若c(Fe3+)增加,Fe3+将I-氧化成I2,则溶液中c(I2)增大,而海水中c(I-)略为减小或忽略不计,导致I2(aq)+I-(aq)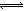 I3-(aq)的平衡右移,I3-浓度增大,D项错误。
I3-(aq)的平衡右移,I3-浓度增大,D项错误。
④读图14,3~18s内第2组实验中I3-浓度由 3.5×10-3mol/L增加到11.8×10-3mol/L,则生成I3-的平均反应速率v(I3-)=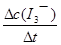 =
=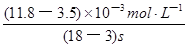 ≈5.5×10-4mol/(L?s),
≈5.5×10-4mol/(L?s),
考点:本题考查盖斯定律、平衡常数、化学平衡移动、反应现象和图像的分析、化学计算。

 名校课堂系列答案
名校课堂系列答案下图是红磷P(s)和Cl2反应生成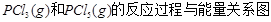 (图中的
(图中的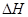 表示生成1mol产物的数据)。根据下图回答下列问题:
表示生成1mol产物的数据)。根据下图回答下列问题:
(1)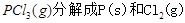 的热化学方程式为 。
的热化学方程式为 。
(2)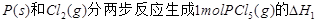 = KJ·mol-1
= KJ·mol-1
(3)研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单地理解为断开1mol化学键时所需吸收的能量,表1所列是部分化学键的键能数据。
表1部分化学键的键能数据
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ·mol-1) | 198 | 360 | 498 | x |
已知1mol白磷(结构如下图所示,分子式为P4)完全燃烧生成P4O10(结构如下图)放出2982KJ热量,则表中:x= 。
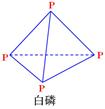 (P4O10)
(P4O10)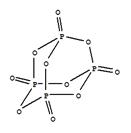
已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
反应②CO(g)+1/2O2(g) CO2(g) ΔH=bkJ·mol-1;
CO2(g) ΔH=bkJ·mol-1;
反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。(2)反应①为 (选填“吸热”或“放热”)反应。(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。A.缩小反应器体积 B.通入CO2
C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图像符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
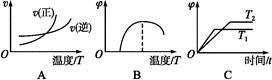
(5)由反应①和②可求得,反应2Fe(s)+O2(g)
 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式: 。
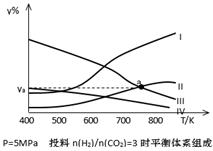
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
(1)写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
(2)对反应Ⅰ,在一定温度下反应达到平衡的标志是 (选填编号)
a.反应物不再转化为生成物 b.平衡常数K不再增大
c.CO2的转化率不再增大 d.混合气体的平均相对分子质量不再改变
(3)在密闭容器中,反应Ⅰ在一定条件达到平衡后,其它条件恒定,能提高CO2转化率的措施是 (选填编号)
| A.降低温度 | B.补充CO2 | C.加入催化剂 | D.移去甲醇 |
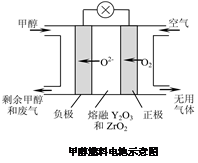
(5)一种以甲醇作燃料的电池示意图如图。写出该电池放电时负极的电极反应式: 。
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=" —1214" kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=" —566" kJ/mol
则表示甲烷燃烧热的热化学方程式 。
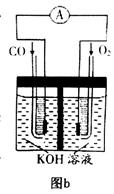
(2) 将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)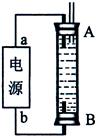
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积
为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
①实验1中,以v (H2)表示的平均反应速率为 。
②实验3跟实验2相比,改变的条件可能是 (答一种情况即可)
 H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则: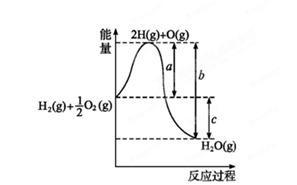
 O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1


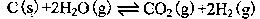 其相关数据如下表所示:
其相关数据如下表所示: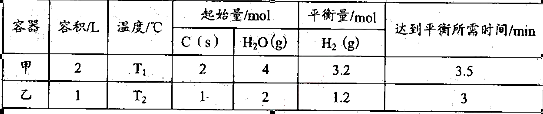
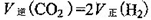
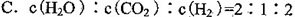
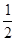 O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1 2NO(g) △H
2NO(g) △H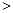 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。  2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。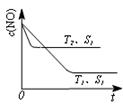
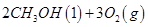 =
= mol
mol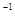
 =
=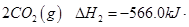 mol
mol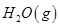 =
=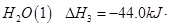 mol
mol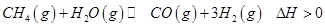
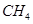 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则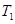
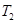 (填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(
(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(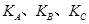 )的大小关系为 ;
)的大小关系为 ;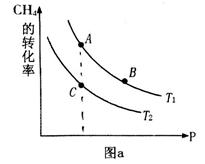
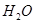 通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。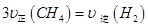
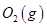 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。