题目内容
(14分)2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要。复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:
⑴火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H="-" 534 kJ·mol-1 ①
H2O2(1)=H2O(1)+1/2O2(g) △H="-" 98.64 kJ·mol-1 ②
H2O(1)=H2O(g) △H=+44kJ·mol-l ③
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H= ,
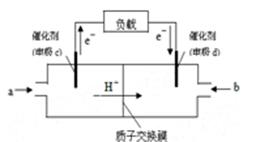
⑵据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作 原料的燃 料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电,其工作原理如图所示。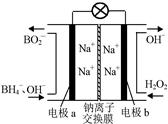
则该电池的正极反应____ ___
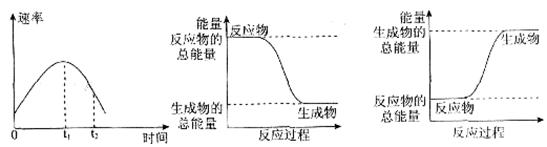
⑶H2O2是一种不稳定易分解的物质。右图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图 。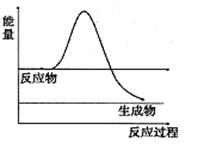
⑷某化学兴趣小组欲测定H2O2的分解速率,取溶液0.5L进行分析,数据如表格所示:
| t(S) | 0 | 2 | 4 | 6 | 8 | 10 |
| n(H2O2) (moL) | 0.8 | 0.7 | 0.62 | 0.55 | 0.27 | 0.03 |
⑸H2O2还是一种药物化学分析的氧化剂,能用于药物的分析。

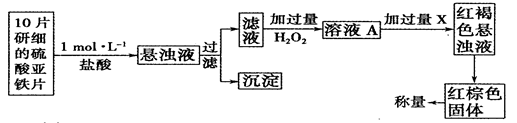
①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。
A.过滤 B.洗涤 C.萃取 D.分液 E.冷却 F.灼烧
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为
_________(小数点后面保留一位有效数字)。
(14分,每空2分) -643.28KJ/mol H2O2+2e-=2OH- 略 0.26 mol/( L.S)
H2O2+2Fe2++2H+=2Fe3++2H2O A.B.F.E 56.7%
解析试题分析:(1)根据盖斯定律得所求△H="①+②×2+③×2=-" 534 kJ·mol-1+(- 98.64 kJ·mol-1 )×2+-44 kJ·mol-1 ×2=-643.28KJ/mol ;
(2)正极发生还原反应,所以从图中可知,正极是过氧化氢的还原反应生成氢氧根离子,电极反应式为H2O2+2e-=2OH-
(3)使用催化剂,可以降低反应的活化能,加快反应速率,但反应热不变,所以在原图的基础上降低曲线的高度,但起点与终点不变;
(4)从表中数据可知,前6s内过氧化氢的物质的量减少缓慢,6s后,过氧化氢的物质的量减少很快,说明此时加入了催化剂,所以6s~10s之间,过氧化氢的浓度减少(0.55mol-0.03mol)/0.5L,则这段时间的平均反应速率为(0.55mol-0.03mol)/0.5L/4s="0.26" mol/( L·S);
(5)①过氧化氢与硫酸亚铁发生氧化还原反应生成硫酸铁和水,离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O
②红棕色固体是氧化铁固体,所以从红褐色浊液到红棕色固体需要过滤沉淀,洗涤沉淀,灼烧沉淀为氧化铁,冷却,最后称量,所以答案选ABFE;
③0.8960g的氧化铁的物质的量是0.0056mol,则药片中硫酸亚铁的质量为0.0056mol×2×152g/mol=1.7024g,10片药片的质量是0.3g×10=3g,所以药片中硫酸亚铁的质量分数为1.7024g/3g×100%=56.7%
考点:考查盖斯定律的应用,电极反应式的书写,反应中催化剂的使用,反应速率的计算,物质判断,质量分数的计算,实验步骤的选择

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案(I)保护环境已成为当前和未来的一项全球性课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示: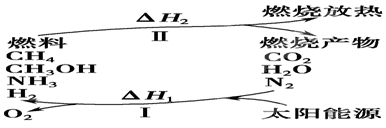
请回答下列问题:
(1)过程Ⅰ的能量转化形式为________能转化为________能。
(2)上述转化过程中,ΔH1和ΔH2的关系是________。
(3)断裂1 mol化学键所需的能量见下表:
| 共价键 | H—N | H—O | N≡N | O=O |
| 断裂1 mol化学键所需能量/(kJ·mol-1) | 393 | 460 | 941 | 499 |
(II)在一试管中加入0.01mol/L的KMnO4酸性溶液和0.1mol/LH2C2O4溶液,在恒温下发生如下反应:
2KMnO4+5 H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2+8H2O。5分钟后测得Mn2+的浓度为0.004mol/L;
(4)试计算0—5分钟内,υ(H2C2O4)=____________。
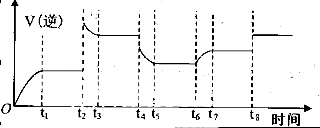
(5)如果反应从开始进行一段时间后,速率—时间图像如图:
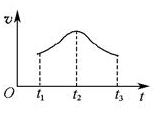 。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。
。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。 下图是红磷P(s)和Cl2反应生成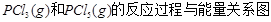 (图中的
(图中的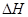 表示生成1mol产物的数据)。根据下图回答下列问题:
表示生成1mol产物的数据)。根据下图回答下列问题:
(1) 的热化学方程式为 。
的热化学方程式为 。
(2) = KJ·mol-1
= KJ·mol-1
(3)研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单地理解为断开1mol化学键时所需吸收的能量,表1所列是部分化学键的键能数据。
表1部分化学键的键能数据
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ·mol-1) | 198 | 360 | 498 | x |
已知1mol白磷(结构如下图所示,分子式为P4)完全燃烧生成P4O10(结构如下图)放出2982KJ热量,则表中:x= 。
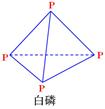 (P4O10)
(P4O10)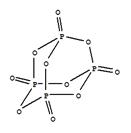
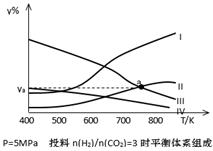
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
(1)写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
(2)对反应Ⅰ,在一定温度下反应达到平衡的标志是 (选填编号)
a.反应物不再转化为生成物 b.平衡常数K不再增大
c.CO2的转化率不再增大 d.混合气体的平均相对分子质量不再改变
(3)在密闭容器中,反应Ⅰ在一定条件达到平衡后,其它条件恒定,能提高CO2转化率的措施是 (选填编号)
| A.降低温度 | B.补充CO2 | C.加入催化剂 | D.移去甲醇 |
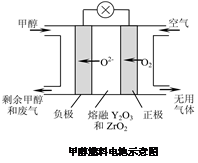
(5)一种以甲醇作燃料的电池示意图如图。写出该电池放电时负极的电极反应式: 。
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)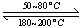 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
B.缩小容器容积,平衡右移, H减小 H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
已知:C(s)+
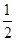 O2(g)=CO(g)
O2(g)=CO(g)  H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1C(s)+ O2(g)=CO2(g)
 H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1S(s)+O2(g)=SO2(g)
 H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1则SO2(g)+2CO(g)=S(s)+2CO2(g)
 H= 。
H= 。(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时
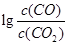 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。
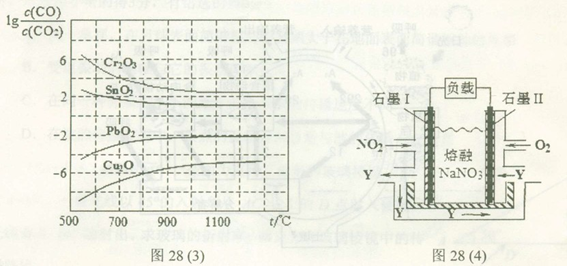
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。



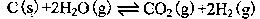 其相关数据如下表所示:
其相关数据如下表所示: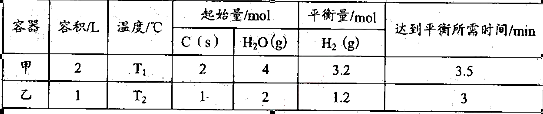
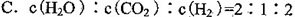
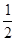 O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1 2NO(g) △H
2NO(g) △H 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。  2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。