题目内容
(15分)氨是最重要的化工产品之一。
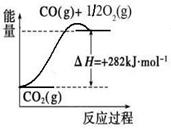
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)  CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。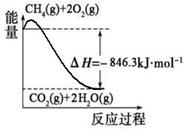

(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO] (l)+CO(g)+NH3(g) [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0
某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为_________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。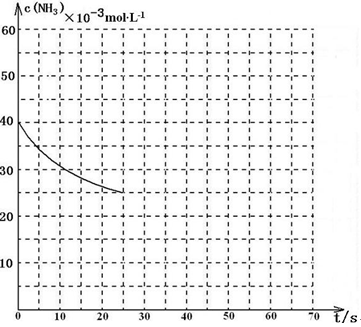
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
(15分)(1)CH4(g)+H2O(g) CO(g)+3H2(g) △H=+161.1 kJ·mol-1(2分) (2)B(2分)
CO(g)+3H2(g) △H=+161.1 kJ·mol-1(2分) (2)B(2分)
(3)2500(2分);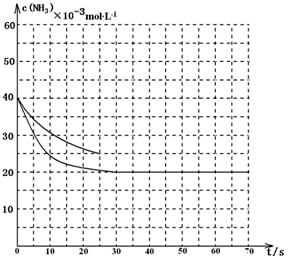 (说明:曲线的转折点在横坐标40之前,纵坐标必需在20的线上)(3分,画出纵坐标为20的直线给2分、画出曲线转折点在横坐标40之前给1分)
(说明:曲线的转折点在横坐标40之前,纵坐标必需在20的线上)(3分,画出纵坐标为20的直线给2分、画出曲线转折点在横坐标40之前给1分)
(4)① 碱 (1分);由于NH3·H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c(OH-)>c(H+),溶液呈碱性(2分) ② A、C、D(3分)
解析试题分析:(1)根据图像可知热化学方程式,①、CH4(g)+2O2(g) 2H2O(g)+CO2(g) △H=-846.3kJ/mol,②、CO(g)+
2H2O(g)+CO2(g) △H=-846.3kJ/mol,②、CO(g)+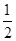 O2(g)
O2(g) CO2(g) △H=+282kJ/mol,③、H2(g)+
CO2(g) △H=+282kJ/mol,③、H2(g)+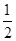 O2(g)
O2(g) H2O(g) △H=-241.8kJ/mol,则根据盖斯定律可知①-②-③×3即得到热化学方程式CH4(g)+H2O(g)
H2O(g) △H=-241.8kJ/mol,则根据盖斯定律可知①-②-③×3即得到热化学方程式CH4(g)+H2O(g) CO(g)+3H2(g),所以该反应的反应热△H=-846.3kJ/mol+282kJ/mol+241.8kJ/mol×3=+161.1 kJ/mol。
CO(g)+3H2(g),所以该反应的反应热△H=-846.3kJ/mol+282kJ/mol+241.8kJ/mol×3=+161.1 kJ/mol。
(2)根据方程式可知该反应是体积减小的、放热的可逆反应,所以要恢复其吸收CO的能力以供循环使用,应该使平衡向逆反应方向移动,所以再生的适宜条件是高温、低压,答案选B。
(3) 2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)
CO(NH2)2(l)+H2O(g)
起始浓度(mol/L) 0.04 0.02 0 0
转化浓度(mol/L) 0.02 0.01 0.01 0.01
平衡浓度(mol/L)0.02 0.01 0.01 0.01
所以该温度下平衡常数K=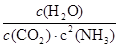 =
= =2500。
=2500。
由于催化剂能加快反应速率,缩短到达平衡的时间,但不能改变平衡状态,据此可以作图。
(4)①根据表中数据可知,NH3·H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,因此溶液中c(OH-)>c(H+),所以溶液呈碱性。
②A、由于CO32-水解程度大于NH4+水解程度,溶液显碱性,则水解程度都是很小的,所以c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3·H2O),A正确;B、根据电荷守恒可知c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),B不正确;C、根据物料守恒可知c(CO32-) + c(HCO3-) +c(H2CO3)=0.1 mol·L-1,C正确;D、碳氧根据物料守恒可知c(NH4+)+ c(NH3·H2O)=2c(CO32-) + 2c(HCO3-) +2c(H2CO3),D正确,答案选ACD。
考点:考查热化学方程式的书写、平衡常数计算、外界条件对平衡状态的影响、溶液酸碱性判断以及溶液中离子浓度大小比较

未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能
| A.①②③④ | B.③⑤⑥⑦ | C.④⑤⑥⑦ | D.③④⑤⑥⑦ |
(共14分)甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。

(3)判断反应③△H 0; △S 0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆)(填“>”“=”或“<”)
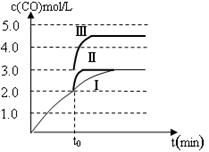
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,
将0.2 mol/L的乙酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=" —1214" kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=" —566" kJ/mol
则表示甲烷燃烧热的热化学方程式 。
(2) 将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
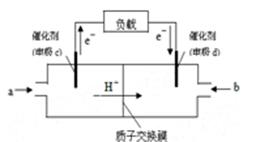
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)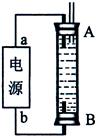
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积
为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
①实验1中,以v (H2)表示的平均反应速率为 。
②实验3跟实验2相比,改变的条件可能是 (答一种情况即可)
 H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则: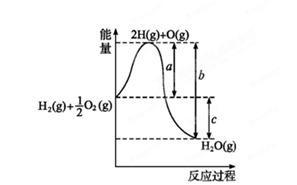
 O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1



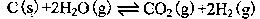 其相关数据如下表所示:
其相关数据如下表所示: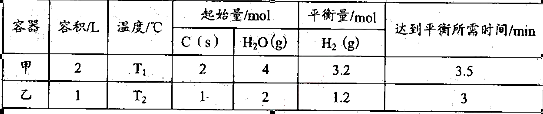
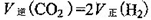
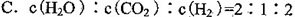
 O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1 2NO(g) △H
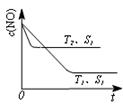
2NO(g) △H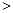 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。  2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。