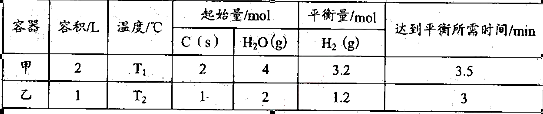
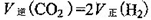题目内容
(16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
反应②: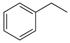 (g)
(g)
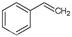 (g)+H2(g),ΔH=" +117.6" kJ/mol。
(g)+H2(g),ΔH=" +117.6" kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
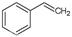
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
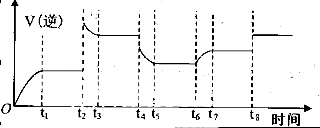
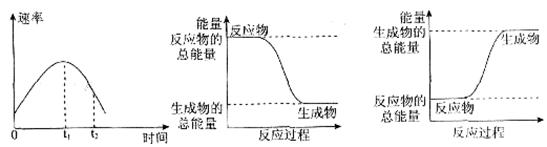
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请
画出t1之后的正逆反应曲线,并作出标注。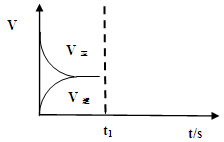
(3)已知某温度下,Ag2SO4饱和溶液中c(Ag+)="0.04" mol/L,则该温度
下Ksp(Ag2SO4)= 。(保留两位有效数字)
(4)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH-=FeO42-+3H2↑,电解质溶液选用NaOH溶液。该电解池阳极材料是 (写化学式);阳极的电极反应式为__ _________。
(1)CO2(g)+ (g)
(g)
 (g)+CO(g)+H2O(g),ΔH="+158.8" kJ/mol(4分;K= K1·K2(2分)
(g)+CO(g)+H2O(g),ΔH="+158.8" kJ/mol(4分;K= K1·K2(2分)
(2)(3分,曲线趋势正确2分,标示正确1分)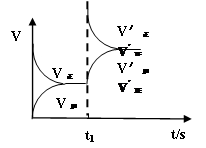
(3)3.2 x 10-5(3分)
(4)Fe(2分);Fe-6e+8OH- =FeO42-+4H2O(2分)
解析试题分析:(1)①+②整理可得二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式是
CO2(g)+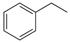 (g)
(g) 
 (g)+CO(g)+H2O(g),ΔH="+158.8" kJ/mol;K1=
(g)+CO(g)+H2O(g),ΔH="+158.8" kJ/mol;K1=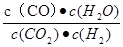 ;K2=
;K2=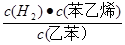 ;K=
;K=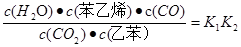 ;(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2,在此时刻,反应物的浓度突然增大,而生成物的浓度不变,所以V正增大,V逆不变,由于V正>V逆,所以平衡正向移动,经过一段时间,当V正=V逆时,反应达到新的平衡,则在t1之后的正逆反应曲线图为:
;(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2,在此时刻,反应物的浓度突然增大,而生成物的浓度不变,所以V正增大,V逆不变,由于V正>V逆,所以平衡正向移动,经过一段时间,当V正=V逆时,反应达到新的平衡,则在t1之后的正逆反应曲线图为: ;(3)已知某温度下,Ag2SO4饱和溶液中c(Ag+)="0.04" mol/L,c(SO42-)=0.02mol/L则该温度下Ksp(Ag2SO4)= c2(Ag+)·c(SO42-)=0.042×0.02="3.2" ×10-5. (4)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH-=FeO42-+3H2↑,电解质溶液选用NaOH溶液。由于Fe失去电子变为FeO42-,所以该电解池阳极材料是Fe;阳极的电极反应式为Fe-6e+8OH- =FeO42-+4H2O。
;(3)已知某温度下,Ag2SO4饱和溶液中c(Ag+)="0.04" mol/L,c(SO42-)=0.02mol/L则该温度下Ksp(Ag2SO4)= c2(Ag+)·c(SO42-)=0.042×0.02="3.2" ×10-5. (4)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH-=FeO42-+3H2↑,电解质溶液选用NaOH溶液。由于Fe失去电子变为FeO42-,所以该电解池阳极材料是Fe;阳极的电极反应式为Fe-6e+8OH- =FeO42-+4H2O。
考点:考查热化学方程式的书写、化学平衡常数的表达式及关系、沉淀溶解平衡、电解池反应原理的知识。

2HI(g)  H2(g)+I2(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
H2(g)+I2(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
| A.该反应为放热反应 |
| B.升高温度,不影响活化分子百分数 |
| C.催化剂能降低该反应的活化能 |
| D.逆反应的活化能等于正反应的活化能 |
含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 | 36.1 |
| *燃烧热/kJ·mol-1 | 1 560.7 | 2 219.2 | 2 877.6 | 3 535.6 |
*燃烧热:1 mol物质完全燃烧,生成二氧化碳、液态水时所放出的热量。
根据表中数据,下列判断错误的是
A.正庚烷在常温常压下肯定不是气体
B.随碳原子数增加,烷烃沸点和燃烧热都成比例增加
C.随碳原子数增加,烷烃沸点逐渐升高
D.烷烃燃烧热随所含碳原子数增加而增加
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能
| A.①②③④ | B.③⑤⑥⑦ | C.④⑤⑥⑦ | D.③④⑤⑥⑦ |
 H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则: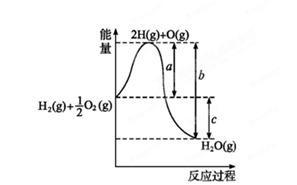
 O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1


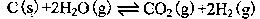 其相关数据如下表所示:
其相关数据如下表所示: