题目内容
20. 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺 酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺 酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | a极为电池的负极 | |
| B. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| C. | 电池工作时,1mol乙醇被还原时就有6mol电子转移 | |
| D. | 电池正极的电极反应为:4H++O2+4e-→2H2O |
分析 由质子的定向移动方向可知a为负极,b为正极,负极发生氧化反应,乙醇被氧化生成CO2和,电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,结合电极反应解答该题.
解答 解:A.原电池工作时,阳离子向正极移动,则a为负极,故A正确;
B.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B正确;
C.已知电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,则1mol乙醇被氧化失去12mol电子,故C错误;
D.正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故D正确;
故选C.
点评 本题考查原电池知识,题目难度中等,本题注意把握根据电池总反应书写电极方程式的方法.

练习册系列答案
相关题目
10.丁香油酚的结构简式是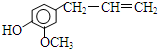 ,该物质不应有的化学性质是( )
,该物质不应有的化学性质是( )
①可以燃烧;②可以跟溴加成;③可以使酸性KMnO4溶液褪色;④可以跟NaHCO3溶液反应;⑤可以跟NaOH溶液反应.
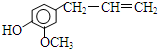 ,该物质不应有的化学性质是( )
,该物质不应有的化学性质是( )①可以燃烧;②可以跟溴加成;③可以使酸性KMnO4溶液褪色;④可以跟NaHCO3溶液反应;⑤可以跟NaOH溶液反应.
| A. | ①③ | B. | ③⑤ | C. | ④⑤ | D. | ④ |
15.下列各种情况下,常温下溶液中一定能大量存在的离子组是( )
| A. | 酸性溶液中可能大量存在:Na+、ClO-、SO42-、CN- | |
| B. | 无色溶液中可能大量存在:Al3+、NH4+、Cl-、S2- | |
| C. | pH=7的中性溶液中:Fe3+、K+、Cl-、SO42- | |
| D. | 由水电离出的c(H+)=l×10-12mol/L的溶液中:K+、Ba2+、Cl-、NO3- |
9.同温同压下,三个等体积的干燥圆底烧瓶中分别充满①HCl ②NO2③体积比为1:1的NO2和O2,进行喷泉实验.经充分反应后烧瓶内溶质的物质的量浓度之比为( )
| A. | 1:1:1 | B. | 4:4:5 | C. | 5:5:4 | D. | 15:10:12 |
 ,第一电离能最小的元素是Cu(填元素符号).
,第一电离能最小的元素是Cu(填元素符号).