题目内容
2.如图是实验室制备四氯化硅的装置示意图.已知:四氯化硅遇水极易反应.
请回答下列问题:
(1)写出装置A中发生反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置A中g管的作用是使溶液顺利滴下.
(3)干燥管F中碱石灰的作用是防止空气中的水蒸气进入h装置与四氯化硅反应.
(4)该组实验装置中存在的缺陷是缺少吸收多余氯气的装置,导致污染环境.
分析 由制备四氯化硅的实验流程可知,A中发生二氧化锰与浓盐酸的反应生成氯气,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,四氯化硅的沸点低,则E装置冷却可收集四氯化硅,F可防止空气中的水进入,以此来解答.
(1)装置A中是实验室利用浓盐酸和二氧化锰混合加热制取氯气;
(2)装置A中通过分液漏斗滴加浓盐酸,使用g装置可使漏斗液面上方与圆底烧瓶内连通,保证压强相等,有利于浓盐酸流下;
(3)F中的碱石灰易吸收水和酸性气体,h装置是收集四氯化硅的,可结合四氯化硅遇水极易水解来考虑;
(4)实验中反应物如果没有全部转化为生成物,过量的氯气因有毒如果不处理会造成环境污染.
解答 解:由制备四氯化硅的实验流程可知,A中发生二氧化锰与浓盐酸的反应生成氯气,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,四氯化硅的沸点低,则E装置冷却可收集四氯化硅,F可防止空气中的水进入,最后要考虑处理含氯气的尾气,防止污染环境.
(1)装置A是氯气发生装置,是利用浓盐酸和二氧化锰混合加热制取氯气,发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸有挥发性,故分液漏斗要加盖,加盖后如没有g管,则盐酸就不易流下去,g管的作用是平衡压强,使液体顺利流出并防止漏气,故答案为:使液体顺利流出并防止漏气;
(3)四氯化碳遇水极易水解,则干燥管F的作用为防止空气中的水蒸气进入h,故答案为:防止空气中的水蒸气进入h;
(4)反应过程中氯气过量,过量的氯气如不处理会造成环境污染,而装置中无尾气处理过程,这是本实验装置的缺陷,故答案为:缺少吸收多余氯气的装置,导致污染环境.
点评 本题考查制备实验方案的设计,为高频考点,把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与评价,题目难度不大.

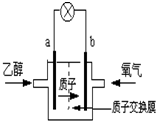 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺 酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺 酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | a极为电池的负极 | |
| B. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| C. | 电池工作时,1mol乙醇被还原时就有6mol电子转移 | |
| D. | 电池正极的电极反应为:4H++O2+4e-→2H2O |
| A. | 混合气体的分子数之比为2:1:2 | |
| B. | 混合气体的压强不再发生变化 | |
| C. | 混合气体的平均相对分子质量不再发生变化 | |
| D. | 混合气体的密度不再发生变化 |
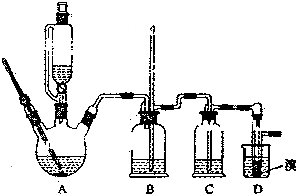 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}So_{4}(浓)}$CH2=CH2+H2O,CH2=CH2+Br2→BRCH2B
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚;浓硫酸把乙醇氧化为CO2等.
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下;
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/°C | 78.5 | 132 | 34.6 |
| 熔点/°C | -130 | 9 | -116 |
(1)A装置上方使用滴液漏斗的优点是:便于漏斗内液体顺利流下;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)B装置的作用是平衡压强,检查装置是否发生堵塞.
(3)在装置C中应加入C(填正确选项前的字母),其目的是吸收反应产物的SO2和CO2酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(5)D装置具支试管内若用嗅水代替液溴(假定产物相同),分析其优点生成的1,2-二溴乙烷和水分层,水在上层起液封作用,防止产品挥发.
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反应的平衡常数均为4 | |
| B. | 容器②中达到平衡时放出的热量为0.05QkJ | |
| C. | 向容器①中通入氦气,平衡时A的转化率不变 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于$\frac{2}{3}$ |
| A. | FeCl3溶液能止血和面粉厂的静电除尘都是利用了胶体的聚沉性质 | |
| B. | 除去锅炉水垢中的CaSO4,可先使用碳酸钠溶液浸泡处理,最后用酸除去 | |
| C. | 大量排放SO2、NO2和CO2都会导致酸雨的形成 | |
| D. | 工业上用NaOH与氯气反应制取漂白粉 |
