题目内容
10.丁香油酚的结构简式是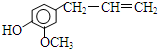 ,该物质不应有的化学性质是( )
,该物质不应有的化学性质是( )①可以燃烧;②可以跟溴加成;③可以使酸性KMnO4溶液褪色;④可以跟NaHCO3溶液反应;⑤可以跟NaOH溶液反应.
| A. | ①③ | B. | ③⑤ | C. | ④⑤ | D. | ④ |
分析 由结构可知,分子中含酚-OH、碳碳双键及醚键、苯环等,结合酚、烯烃的性质来解答.
解答 解:为烃的含氧衍生物,可燃烧生成二氧化碳和水;
含碳碳双键,可与溴发生加成反应,与高锰酸钾发生氧化反应;
含酚-OH,可与NaOH反应,而不与NaHCO3溶液不反应,
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、烯烃性质的考查,题目难度不大.

练习册系列答案
相关题目
20.下列装置能达到相应实验目的是( )
| A. |  验证碳酸的酸性强于硅酸 | B. |  分离苯和酒精 | ||
| C. |  制取少量O2 | D. |  收集少量NO2气体 |
1.下列物质间发生反应时,都有SO2生成的是:( )
①硫在空气中燃烧 ②含硫的化合物在空气中灼烧 ③亚硫酸钠和硫酸反应 ④硫化氢在空气中完全燃烧 ⑤铜和热浓硫酸反应.
①硫在空气中燃烧 ②含硫的化合物在空气中灼烧 ③亚硫酸钠和硫酸反应 ④硫化氢在空气中完全燃烧 ⑤铜和热浓硫酸反应.
| A. | 只有①③④ | B. | 只有①⑤ | C. | 只有①③④⑤ | D. | ①②③④⑤ |
18.下列说法你认为不合理的是( )
| A. | 使用一次性筷子,既方便又卫生,且耗木才不多、应提倡大量使用 | |
| B. | 塑料像把双刀剑,它既可极大地方便人们的生活,又给环境带来污染 | |
| C. | 甲烷是优良的气体燃料,但矿井里由于它的存在,在通风不良时,易发生爆炸 | |
| D. | 大气中CO2的浓度不断上升,使全球变暖,但同时也有利于植物光合作用 |
5.下列表示物质结构的化学用语或模型正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | B. | CH4分子的球棍模型: | ||
| C. | 醛基的电子式: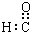 | D. | 葡萄糖的最简式(实验式):CH2O |
15. 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )| A. | 2:7 | B. | 5:4 | C. | 4:5 | D. | 7:3 |
2.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:
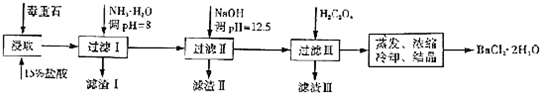
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
加入NH3•H2O调节pH=8可除去Fe3+(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H2O Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.则BaCl2溶液的浓度为$\frac{({V}_{0}-{V}_{1})b}{y}$mol•L-1.

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H2O Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.则BaCl2溶液的浓度为$\frac{({V}_{0}-{V}_{1})b}{y}$mol•L-1.
19.下列关于燃烧热的说法中正确的是 ( )
| A. | 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 常温下,可燃物燃烧放出的热量 | |
| C. | 在25℃、1.01×105Pa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量 | |
| D. | 燃烧热随化学方程式前的化学计量数的改变而改变 |
20.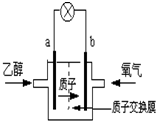 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺 酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺 酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺 酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺 酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | a极为电池的负极 | |
| B. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| C. | 电池工作时,1mol乙醇被还原时就有6mol电子转移 | |
| D. | 电池正极的电极反应为:4H++O2+4e-→2H2O |