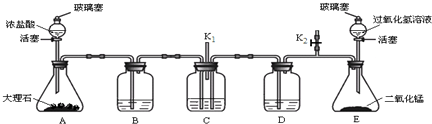
题目内容
9.同温同压下,三个等体积的干燥圆底烧瓶中分别充满①HCl ②NO2③体积比为1:1的NO2和O2,进行喷泉实验.经充分反应后烧瓶内溶质的物质的量浓度之比为( )| A. | 1:1:1 | B. | 4:4:5 | C. | 5:5:4 | D. | 15:10:12 |
分析 相同条件下,等体积的气体其物质的量相等,氯化氢极易溶于水,则盛有氯化氢的烧瓶分别倒立在水槽中时,水会充满整个烧瓶;二氧化氮和水反应方程式为:3NO2+H2O=2HNO3+NO,根据方程式可知,水充入烧瓶容积的$\frac{2}{3}$,据反应4NO2+O2+2H2O=4HNO3计算出反应后溶质的物质的量,再根据c=$\frac{n}{V}$计算溶液的物质的量浓度.
解答 解:相同条件下,等体积的气体的物质的量相等,氨气和氯化氢极易溶于水,则盛有等体积氯化氢、氨气的烧瓶分别倒立在水槽中时,水会充满整个烧瓶;
二氧化氮和水反应方程式为:3NO2+H2O=2HNO3+NO,根据方程式知,水会充入烧瓶容积的$\frac{2}{3}$,溶液中的溶质是硝酸,其物质的量是二氧化氮的$\frac{2}{3}$,
假设烧瓶的体积为1L,该条件下气体摩尔体积为Vm,则:n(HCl)=n(NO2)=$\frac{1}{Vm}$mol,
溶液中溶质的物质的量分别为:n(HCl)=$\frac{1}{Vm}$,n(HNO3)=$\frac{1}{Vm}$×$\frac{2}{3}$,
溶液的体积分别为:V(HCl)=1L,V(HNO3)=$\frac{2}{3}$L,
根据c=$\frac{n}{V}$知,两种溶液的物质的量浓度相等,都是$\frac{1}{Vm}$mol/L,
体积比为1:1的NO2和O2的混合气中,假设体积都为VL,根据以下方程式反应:4NO2+O2+2H2O=4HNO3,所以氧气剩余0.75V,而且生成硝酸物质的量为:$\frac{V}{Vm}$mol,烧瓶充满溶液其体积为2V-0.75V=1.25VL,所以溶质的物质的量浓度为$\frac{\frac{V}{Vm}}{1.25V}$mol/L=$\frac{1}{Vm}$×$\frac{4}{5}$mol/L,所以所得三种溶液的物质的量浓度之比为$\frac{1}{Vm}$mol/L:$\frac{1}{Vm}$mol/L:($\frac{1}{Vm}$×$\frac{4}{5}$)mol/L=5:5:4,
故选C.
点评 本题考查了物质的量浓度的有关计算,题目难度中等,可以根据c=$\frac{n}{V}$分析解答,明确溶液中的溶质是解本题的关键,注意盛放二氧化氮的烧瓶中水的体积及溶质的物质的量,为易错点.

| A. | 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 常温下,可燃物燃烧放出的热量 | |
| C. | 在25℃、1.01×105Pa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量 | |
| D. | 燃烧热随化学方程式前的化学计量数的改变而改变 |
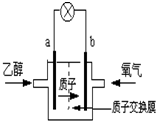 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺 酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺 酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | a极为电池的负极 | |
| B. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| C. | 电池工作时,1mol乙醇被还原时就有6mol电子转移 | |
| D. | 电池正极的电极反应为:4H++O2+4e-→2H2O |
| A. | 两者的本质区别是氢氧化铁胶体能产生丁达尔现象 | |
| B. | 都能透过半透膜 | |
| C. | 都是透明的澄清液体 | |
| D. | 都呈红褐色 |
| A. | 混合气体的分子数之比为2:1:2 | |
| B. | 混合气体的压强不再发生变化 | |
| C. | 混合气体的平均相对分子质量不再发生变化 | |
| D. | 混合气体的密度不再发生变化 |
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反应的平衡常数均为4 | |
| B. | 容器②中达到平衡时放出的热量为0.05QkJ | |
| C. | 向容器①中通入氦气,平衡时A的转化率不变 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于$\frac{2}{3}$ |