题目内容
【题目】随着科技进步和人类环保意识的增强,如何利用CO2已经成为世界各国特别关注的问题。
已知:CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
(1)降低温度,该反应速率会_______________(填“增大”或“减小”);一定压强下,由最稳定单质生1 mol化合物的焓变为该物质的摩尔生成焓。已知CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。则上述重整反应的ΔH=____________kJ/mol。
(2)T1℃时,在两个相同刚性密闭容器中充入CH4和CO2分压均为20 kPa,加入催化剂Ni/α-Al2O3并分别在T1℃和T2℃进行反应,测得CH4转化率随时间变化如图Ⅰ所示。
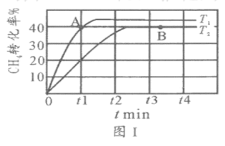
①A点处v正_______B点处(填“<”、“>”或“=”)
②研究表明CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=__________mol·g-1·s-1。
(3)上述反应达到平衡后,若改变某一条件,下列变化能说明平衡一定正向移动的是________________(填代号)。
A.正反应速率增大 B.生成物的百分含量增大 C.平衡常数K增大
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点___________________(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____________;CH4的转化率b点高于a点的可能原因是_________________________________。
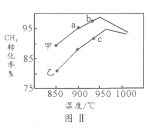
【答案】减小 +249.1 > 1.872 C 一定未 催化剂不会改变平衡转化率,乙催化剂c点未与甲催化剂同样温度的点相交,转化率不相等,说明c点不是平衡转化率 b和a两点反应都未达平衡,b点温度高,反应速率快,相同时间内转化率高(或其它合理答案)
【解析】
(1)降低温度,降低反应混合物中分子所具有的能量;
反应焓变△H=生成物的反应焓之和-反应物的反应焓之和;
(2)①根据图Ⅰ,T1的温度高于T2,速率大;
②由图,A点甲烷的转化率为40%,算出分压,代入公式计算;
(3)A.正反应速率增大,如逆速率同等程度地增加,平衡不移动;
B.向反应体系中投入某生成物,生成物的百分含量增大,但平衡逆向移动;
C.平衡常数K增大,平衡正向进行的程度增大;
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点一定未达到平衡状态,理由是催化剂不会改变平衡转化率,乙催化剂c点未与甲催化剂同样温度的点相交,转化率不相等,说明c点不是平衡转化率;
CH4的转化率b点高于a点的可能原因是:b和a两点反应都未达平衡,b点温度高,反应速率快,相同时间内转化率高(或其它合理答案)。
(1)降低温度,降低反应混合物中分子所具有的能量,该反应速率会减小;
CH 4(g)与CO 2(g)反应生成CO(g)和H 2(g)的方程式:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。根据此定义,稳定单质的摩尔生成焓为0,反应焓变△H=2×(-110.4KJ·mol-1)-[(-395KJ·mol-1)+(-74.9KJ·mol-1)]=+249.1kJ·mol-1,反应的热化学方程式为:CH4(g)+CO2(g)
2CO(g)+2H2(g),CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。根据此定义,稳定单质的摩尔生成焓为0,反应焓变△H=2×(-110.4KJ·mol-1)-[(-395KJ·mol-1)+(-74.9KJ·mol-1)]=+249.1kJ·mol-1,反应的热化学方程式为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)△H=+249.1kJ·mol-1。
2CO(g)+2H2(g)△H=+249.1kJ·mol-1。
(2)①根据图Ⅰ,T1的温度高于T2,A点处v正>B点处;
②由图,A点甲烷的转化率为40%,结合方程式CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),p(CH4)=20KPa×(1-40%)=12kPa=p(CO2),CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=1.3×10-2×12×12mol·g-1·s-1=1.872mol·g-1·s-1。
2CO(g)+2H2(g),p(CH4)=20KPa×(1-40%)=12kPa=p(CO2),CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=1.3×10-2×12×12mol·g-1·s-1=1.872mol·g-1·s-1。
(3)A.正反应速率增大,如逆速率同等程度地增加,平衡不移动,故A不符;
B.向反应体系中投入某生成物,生成物的百分含量增大,但平衡逆向移动,故B不符;
C.平衡常数K增大,平衡正向进行的程度增大,故C符合;
故选C。
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点一定未达到平衡状态,理由是催化剂不会改变平衡转化率,乙催化剂c点未与甲催化剂同样温度的点相交,转化率不相等,说明c点不是平衡转化率;
CH4的转化率b点高于a点的可能原因是:b和a两点反应都未达平衡,b点温度高,反应速率快,相同时间内转化率高(或其它合理答案)。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)