题目内容
【题目】乙醇在生产生活中有着广泛的用途。
(1)乙醇的官能团是_______。
(2)工业生产中,用乙烯与水反应制得乙醇,该反应类型为_________。
(3)乙醇与乙酸反应可制得香料乙酸乙酯,乙酸乙酯的结构简式为___________。
(4)乙醇在铜作催化剂条件下可被氧化为乙醛,写出反应的化学方程式__________。
(5)交警常使用酒精检测仪来检验机动车司机是否酒驾,其原理是:司机口中呼出的乙醇可以使检测仪中的橙色重铬酸钾(K2Cr2O7)转变为绿色的硫酸铬[Cr2(SO4)3],上述反应涉及的乙醇性质有________。
A.无色液体 B.密度比水的小 C.易挥发 D.具有还原性
【答案】羟基 加成反应 CH3COOCH2CH3 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CD
2CH3CHO+2H2O CD
【解析】
乙醇的结构式为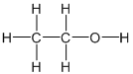 ,含有的官能团是-OH为羟基。
,含有的官能团是-OH为羟基。
(1)乙醇的官能团是羟基,故答案为:羟基;
(2)乙烯与水反应制得乙醇,反应方程式:CH2=CH2+H2O![]() CH3CH2OH,反应类型为加成反应,故答案为:加成反应
CH3CH2OH,反应类型为加成反应,故答案为:加成反应
(3)乙醇与乙酸反应可制得香料乙酸乙酯,反应方程式:CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,则乙酸乙酯的结构简式为:CH3COOCH2CH3,故答案为:CH3COOCH2CH3;
CH3COOCH2CH3+H2O,则乙酸乙酯的结构简式为:CH3COOCH2CH3,故答案为:CH3COOCH2CH3;
(4)乙醇在铜作催化剂条件下可被氧化为乙醛,反应的化学方程式:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
(5)呼出乙醇,说明的易挥发性,乙醇可以使检测仪中的橙色重铬酸钾(K2Cr2O7)转变为绿色的硫酸铬[Cr2(SO4)3],Cr元素化合价从+6降至+3,说明发生了氧化还原反应,重铬酸钾为氧化剂,则乙醇做还原剂,具有还原性,故答案为:CD。

【题目】下列方案设计能达到实验目的的是
A | B | C | D |
检验淀粉是否水解 | 由褪色快慢研究反应物浓度对反应速率的影响 | 证明发生了取代反应 | 验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ] |
|
|
|
|
A.AB.BC.CD.D