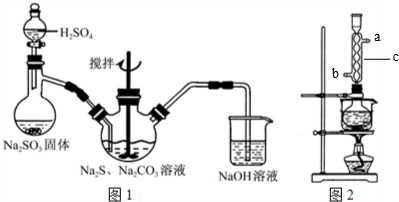
题目内容
17.25℃时,下列有关电解质溶液中微粒的关系正确的是( )| A. | pH=4的NaHSO3溶液中:c(SO32-)<c(H2SO3) | |
| B. | pH=3的氯化铵溶液与pH=3的盐酸中水的电离程度相同 | |
| C. | 将pH=5的醋酸溶液稀释后,所有离子浓度均减小,pH增大 | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
分析 A.NaHSO3溶液的pH=4,说明HSO3-的电离程度大于其水解程度,则c(SO32-)>c(H2SO3);
B.氯化铵中,铵根离子水解促进了水的电离,盐酸中氢离子抑制了水的电离;
C.醋酸稀释后,溶液中氢离子浓度减小,由于水的离子积不变,则溶液中氢氧根离子浓度增大;
D.反应生成亚硫酸钠、硫酸铵溶液,铵根离子部分水解,溶液呈酸性,结合物料守恒进行判断各离子浓度大小.
解答 解:A.pH=4的NaHSO3溶液,溶液呈酸性,说明HSO3-的电离程度大于其水解程度,则c(SO32-)>c(H2SO3),故A错误;
B.pH=3的氯化铵溶液与pH=3的盐酸中,前者促进了水的电离,溶液中氢离子是水电离的,而后者抑制了水的电离,盐酸中氢氧根离子是水电离的,所以前者溶液中水的电离程度远远大于后者,故B错误;
C.醋酸被稀释后,溶液中氢离子浓度减小,溶液的pH增大,在稀释过程中由于溶液温度不变,则水的离子积不变,所以溶液中氢氧根离子浓度增大,故C错误;
D.NH4HSO4溶液中加入等物质的量的NaOH形成的溶液,反应生成等浓度的硫酸钠和硫酸铵,由于铵根离子部分水解、钠离子和硫酸根离子不水解,溶液呈酸性,则:c(Na+)=c(SO42-)>c(NH4+)、c(H+)>c(OH-),溶液中离子浓度大小为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及水的电离及其影响、盐的水解原理、弱电解质的电离、离子浓度大小判断等知识,明确电荷守恒、物料守恒及盐的水解原理为解答关键,C为易错点,注意溶液中氢氧根离子浓度增大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
15.下列实验能达到预期目的是( )
| A. | 向淀粉溶液中加入稀硫酸加热后,再用NaOH中和,并做新制氢氧化铜反应实验--检验淀粉是否水解 | |
| B. | 向1-溴丙烷中加入氢氧化钠溶液并加热,再滴加硝酸银和稀硝酸溶液--检验有机物中是否含有溴元素 | |
| C. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| D. | 向含苯酚的苯溶液中滴加浓溴水,过滤--除去苯中的苯酚 |
16.下列说法正确的是( )
| A. | 原硅酸是白色胶状物,失去部分水后变成白色粉末状硅酸 | |
| B. | SiO2分子由一个硅原子和两个氧原子构成 | |
| C. | SiO2溶于水后则慢慢生成硅酸 | |
| D. | SiO2既能与酸反应,又能与强碱反应,故它是两性氧化物 |
12. 2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )
2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )
 2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )
2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )| A. | PX是一种有机化合物 | |
| B. | 仅由碳、氢两种元素组成 | |
| C. | 爆炸燃烧的产物是可能是CO2和H2O | |
| D. | 该有机化合物分子中存在碳碳单键,也存在碳碳双键 |
2.下列说法正确的是( )
| A. | 自然界中含有大量游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| B. | Si、P、S、Cl相应的氧化物对应水化物的酸性依次增强 | |
| C. | 工业上通常用电解熔融氧化铝制得金属铝 | |
| D. | 金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步发生 |
9.氯霉素是一种常见的药物,实验发现由于其分子结构中含有羟基而具有苦味.但如果将其分子中碳链末端的羟基中的氢原子换成来自棕榈酸中的原子团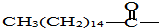 后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
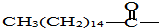 后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )| A. | 无味氯霉素的水溶性变差,所以苦味消失 | |
| B. | 无味氯霉素失去了药性,所以苦味消失 | |
| C. | 无味氯霉素是棕榈酸的盐类 | |
| D. | 无味氯霉素在人体内不会发生水解 |
6.日本冈山大学教授滨田博喜和研究员富良德等通过实验发现,桉树叶子的培养细胞能够消除有害化学物质双酚A的毒性.双酚A的结构简式如图所示,下列有关此物质的说法正确的是( )
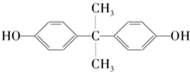

| A. | 1 mol该物质与足量溴水反应消耗2 mol Br2 | |
| B. | 该物质能与碳酸氢钠溶液反应放出CO2 | |
| C. | 该物质的所有碳原子可能在同一平面 | |
| D. | 该物质与足量氢气发生加成反应后所得物质的化学式为C15H28O2 |
7.常温下下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+ | |
| C. | c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+ | |
| D. | c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |